
【题目】已知:对于电离常数为Ka的某一元弱酸,pH突变随其浓度的增大而增大,且浓度主要影响滴定终点和滴定终点之后的曲线部分。常温下,用不同浓度的NaOH溶液分别滴定20mL与其同浓度的某弱酸HA溶液,滴定曲线如图所示。下列说法不正确的是
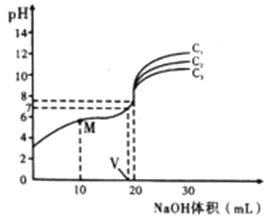
A. 由图可知:c1>c2>c3
B. M点溶液中存在:c(H+)+c(HA)=c(OHˉ)+c(Aˉ)
C. 恰好中和时,溶液中离子浓度的大小关系:c(Na+)>C(Aˉ ) >C(OHˉ )>c(H+)
D. 计算可知HA的电离常数:Ka=![]()
【答案】B
【解析】A. 酸碱完全中和后,随着氢氧化钠的加入,氢氧根离子浓度增大,增大越趋势越大,说明所加氢氧化钠的浓度越大,故由图可知:c1>c2>c3,选项A正确;B. M点为NaA和HA按1:1形成的溶液,根据电荷守恒存在:c(H+)+ c(Na+) =c(OHˉ)+c(Aˉ),且c(Na+)>c(HA),故c(H+)+c(HA)<c(OHˉ)+c(Aˉ),选项B不正确;C. 恰好中和时溶液呈碱性,为强碱弱酸盐NaA溶液,故离子浓度的大小关系:c(Na+)>C(Aˉ ) >C(OHˉ )>c(H+),选项C正确;D. 当加入氢氧化钠的体积为V时溶液呈中性,计算可知HA的电离常数:Ka=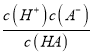 =
=![]() ,选项D正确。答案选B。
,选项D正确。答案选B。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热△H=﹣57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(﹣57.3)kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+ ![]() O2(g)═CO2 (g);△H=﹣283.0kJ/mol
O2(g)═CO2 (g);△H=﹣283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol硫燃烧生成气态三氧化硫所放出的热量是硫磺的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设nA代表阿伏伽德罗常数(NA)的数值,下列说法正确的是( )
A.22.4L中含有nA个分子
B.1L0.1mol/LNa2SO4溶液中有0.1个Na+
C.1molH2与1molCl2反应生成nA个HCl分子
D.1molCa变成Ca2+时失去的电子数为2nA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的位置如下表所示.下列说法正确的是( ) 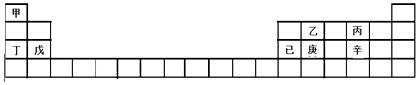
A.甲、丁、戊的单质都是金属
B.乙、丙、辛都是非金属元素
C.乙、庚、辛都能形成氧化物
D.已的氧化物既可溶于KOH溶液又可溶于H2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学变化是有条件的。某小组同学探究I-与金属阳离子的氧化还原反应,实验过程如下。
已知同浓度的稀溶液中氧化性:Ag+>Fe3+>Cu2+。
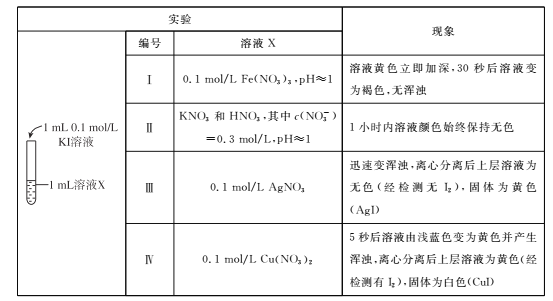
(1)根据实验I和Ⅱ,请回答下列问题。
①由“黄色立即加深”初步判断有I2生成,选择 ___(填试剂)进一步证实生成了I2。
②写出Fe3+与I-反应的离子方程式__,该条件下氧化性:Fe2+ __ I2(选填“>”或“<”)。
③实验Ⅱ的目的是____。
(2)实验Ⅳ中Cu2+与I-反应的离子方程式是___,甲同学得出氧化性:Cu2+ >I2。
(3)乙同学认为甲同学的结论不合理,分析原因:实验Ⅲ应有 I2生成,但却生成了AgI沉淀,因此推测实验Ⅳ中I2的生成,与Cul沉淀有关,故不能确定氧化性:Cu2+>I2,并用下图装置进行验证。

K闭合后,较长时间发现两侧溶液均无明显变化。乙同学为了进一步判断Cu2+和I2的氧化性强弱,将左侧电极改为Cu电极,并向右侧溶液中加入少量 ___(填试剂),发现指针偏转,且左侧溶液颜色加深,证明该条件下氧化性:Cu2+ __ I2(选填“>”或“<”)。
(4)该小组同学进一步分析认为,实验Ⅲ没有发生2Ag++ 2I-=2Ag+I2的反应,原因是生成AgI沉淀,反应物浓度迅速降低,不利于该反应进行;请分析实验Ⅳ发生氧化还原反应的原因是____。
(5)小组同学反思实验,反应体系中,各物质浓度对氧化还原反应是否发生都有一定的影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用离子方程式“H++OH﹣═H2O”表示的化学反应是( )
A.4HNO3 ![]() 2H2O+4H2O↑+O2↑
2H2O+4H2O↑+O2↑
B.NaOH+HCl═NaCl+H2O
C.CaCO3+2HCl═CaCl2+CO2↑+H2
D.2H2+O2 ![]() 2H2O
2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各题
(1)铵态氮肥不稳定,受热易分解.写出氯化铵(NH4Cl)受热发生分解反应的化学方程式 .
(2)乙烯能使溴水褪色,生成1,2﹣二溴乙烷(CH2 Br﹣CH2 Br).写出该反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在l0L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
4NO(g)+6H2O(g)在l0L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率![]() 可表示为
可表示为
A. ![]() =0.010mol/(L·s) B.
=0.010mol/(L·s) B. ![]() =0.0010 mol/(L·s)
=0.0010 mol/(L·s)
C. ![]() =0.0010 mol/(L·s) D.
=0.0010 mol/(L·s) D. ![]() =0.0045 mol/(L·s)
=0.0045 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关甲烷的叙述正确的是( )
A.甲烷不能使高锰酸钾酸性溶液褪色,所以甲烷不能发生氧化反应
B.甲烷与氯气的取代反应,生成的产物中CH3Cl最多
C.CH4的键角均为10928,可以说明甲烷分子是以碳原子为中心的正四面体结构,而不是平面正方形结构
D.甲烷、乙烷、丙烷是同系物,它们中的化学键都是极性共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com