
【题目】化学变化是有条件的。某小组同学探究I-与金属阳离子的氧化还原反应,实验过程如下。
已知同浓度的稀溶液中氧化性:Ag+>Fe3+>Cu2+。
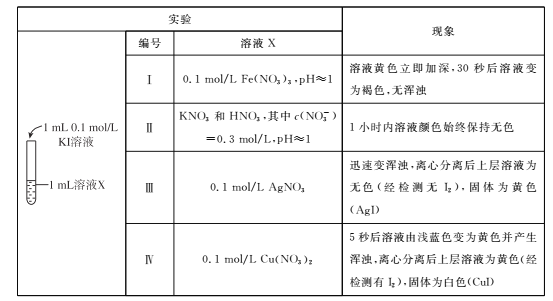
(1)根据实验I和Ⅱ,请回答下列问题。
①由“黄色立即加深”初步判断有I2生成,选择 ___(填试剂)进一步证实生成了I2。
②写出Fe3+与I-反应的离子方程式__,该条件下氧化性:Fe2+ __ I2(选填“>”或“<”)。
③实验Ⅱ的目的是____。
(2)实验Ⅳ中Cu2+与I-反应的离子方程式是___,甲同学得出氧化性:Cu2+ >I2。
(3)乙同学认为甲同学的结论不合理,分析原因:实验Ⅲ应有 I2生成,但却生成了AgI沉淀,因此推测实验Ⅳ中I2的生成,与Cul沉淀有关,故不能确定氧化性:Cu2+>I2,并用下图装置进行验证。

K闭合后,较长时间发现两侧溶液均无明显变化。乙同学为了进一步判断Cu2+和I2的氧化性强弱,将左侧电极改为Cu电极,并向右侧溶液中加入少量 ___(填试剂),发现指针偏转,且左侧溶液颜色加深,证明该条件下氧化性:Cu2+ __ I2(选填“>”或“<”)。
(4)该小组同学进一步分析认为,实验Ⅲ没有发生2Ag++ 2I-=2Ag+I2的反应,原因是生成AgI沉淀,反应物浓度迅速降低,不利于该反应进行;请分析实验Ⅳ发生氧化还原反应的原因是____。
(5)小组同学反思实验,反应体系中,各物质浓度对氧化还原反应是否发生都有一定的影响。
【答案】 淀粉溶液或CCl4 2Fe3++2I-=2Fe2++I2 > 对比实验排除了本实验条件下,I2的生成是由NO3-或溶液中的O2氧化得到 2Cu2++4I-=2CuI↓+I2 I2 < 2Cu2++2I-![]() 2Cu++ I2,由于Cu+与I-生成CuI沉淀,产物浓度迅速降低,促进反应进行
2Cu++ I2,由于Cu+与I-生成CuI沉淀,产物浓度迅速降低,促进反应进行
【解析】(1)①碘单质的检验可以用淀粉溶液也可以用四氯化碳溶液。②Fe3+具有氧化性,I-具有还原性,两者会发生氧化还原反应,由强制线弱的规律,很容易比较氧化性的关系。③对比实验,排除了本实验条件下,I2的生成可能是由NO3-或溶液中的O2氧化得到。
(2)Cu2+与I-发生氧化还原反应,由反应现象推出产物为I2,CuI,方程式为:2Cu2++4I-=2CuI↓+I2)。
(3)开始K闭合时,较长时间两侧溶液无明现象,说明Cu2+未能将I-氧化,后期更改电极,并向右侧加I2,指针偏转,左侧溶液加深,说明I2将Cu氧化成Cu2+,由此可说明氧化性: Cu2+< I2
(4)Cu+与I-生成CuI沉淀,产物浓度迅速降低,促进2Cu2++2I-![]() 2Cu++ I2反应进行。
2Cu++ I2反应进行。


科目:高中化学 来源: 题型:
【题目】下列离子在溶液中可以大量共存的一组是( )
A.K+、Na+、SO42-B.K+、H+、OH-
C.Na+、Ag+、Cl-D.Ca2+、OH-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于构成生物体的化学元素和化合物的叙述中,正确的是
A. 蛋白质结构多样性取决于氨基酸的种类、数量、排列顺序和空间结构
B. 青蛙和玉米细胞中的化学元素在种类和含量上基本相同
C. Mg是植物体中各色素分子必不可少的组成元素
D. C、H、O、N是组成生物体的基本元素,其中C是最基本元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是产生和收集气体的实验装置,该装置适合于( ) 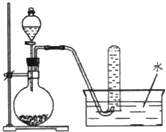
A.用浓硝酸与Cu反应制取NO2
B.用浓盐酸和MnO2反应制取Cl2
C.用H2O2溶液和MnO2反应制取O2
D.用NH4Cl溶液和Ca(OH)2反应制取NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是中学常用的试剂。工业上用软锰矿制备高锰酸钾流程如下。
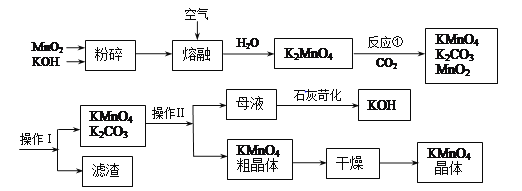
(1)铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式__________。
(2)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是________(填代号)。
a.84消毒液(NaClO溶液) b.双氧水 c.75%酒精 d.肥皂水
(3)上述流程中可以循环使用的物质有________、________(写化学式)。
(4)理论上(若不考虑物质循环与制备过程中的损失)1molMnO2可制得________molKMnO4。
(5)操作Ⅰ的名称是________;操作Ⅱ根据KMnO4和K2CO3两物质在溶解度上的差异,采用________(填操作步骤)、趁热过滤得到KMnO4粗晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:对于电离常数为Ka的某一元弱酸,pH突变随其浓度的增大而增大,且浓度主要影响滴定终点和滴定终点之后的曲线部分。常温下,用不同浓度的NaOH溶液分别滴定20mL与其同浓度的某弱酸HA溶液,滴定曲线如图所示。下列说法不正确的是
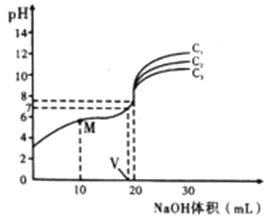
A. 由图可知:c1>c2>c3
B. M点溶液中存在:c(H+)+c(HA)=c(OHˉ)+c(Aˉ)
C. 恰好中和时,溶液中离子浓度的大小关系:c(Na+)>C(Aˉ ) >C(OHˉ )>c(H+)
D. 计算可知HA的电离常数:Ka=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | C | N | O | F | Ne | |||
3 | Na | Al | P | S | Cl |
(1)单质的化学性质最不活沷的元素是;
(2)氧的原子结构示意图是;
(3)形成化合物种类最多的元素是;
(4)HF和H2O中,热稳定性较强的是;
(5)N和P中,原子半径较小的是;
(6)常温下,会在浓硫酸中发生钝化的金属是;
(7)元素最高价氧化物对应水化物中,碱性最强的是(填化学式),酸性最强的是(填“H2SO4”或“HClO4”);
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式 , 其中硫元素和氧元素的质量比m(S):m(O)= . (相对原子质量:S﹣32,O﹣16)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用可溶性钡盐检验SO42-离子的存在时,先在待测溶液中加入盐酸,其作用是 ( )
A.形成较多的白色沉淀B.排除SO42-以外的其它阴离子及Ag+的干扰
C.形成的沉淀纯度更高D.排除Ba2+以外的其它阳离子的干扰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+Br2(l)=2HBr(g) H=-akJ/mol,蒸发1molBr2(l)需要吸收的能量为30kJ,其他数据如下表:
H2(g) | Br2(g) | HBr(g) | |
1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | b | 369 |
下列说法正确的是
A. 2HBr(g)=H2(g)+Br2(g)H=+akJ/mol
B. H2(g)的稳定性低于HBr(g)
C. Br2(g)=Br2(l) H=+30kJ/mol
D. b=272-a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com