
【题目】下列离子在溶液中可以大量共存的一组是( )
A.K+、Na+、SO42-B.K+、H+、OH-
C.Na+、Ag+、Cl-D.Ca2+、OH-、CO32-
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]﹣ , 铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法. 【方法一】还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬.具体流程如下:![]()
有关离子完全沉淀的pH如下表:
有关离子 | Fe2+ | Fe3+ | Cr3+ |
完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(1)写出Cr2O72﹣与FeSO4溶液在酸性条件下反应的离子方程式 .
(2)还原+6价铬还可选用以下的试剂(填序号).
A.明矾
B.铁屑
C.生石灰
D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4 , 再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.则在操作②中可用于调节溶液pH的试剂为:(填序号); A.Na2O2 B.Ba(OH)2 C.Ca(OH)2
此时调节溶液的pH范围在(填序号)最佳.
A.3~4 B.6~8 C.10~11 D.12~14
(4)【方法二】电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去. 写出阴极的电极反应式 .
(5)电解法中加入氯化钠的作用是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为青铜器在潮湿环境中发生的电化学腐蚀的示意图. ①环境中的Cl﹣扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为;
②若生成4.29g Cu2(OH)3Cl,则理论上耗氧气体积为L(标准状况).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体内微量元素的含景其微,但是对人体的健康却起着重耍作用。下列各组元素全部是微量元素的是
A. Na、K、0、S B. Mo、Fe、Zn、Cu
C. N、H、0、P、C D. Fe、Ca、Cu、Mg、C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外研究性学习小组用如图所示装置制备少量溴苯并验证溴与苯的反应是取代反应. 
实验时,关闭F火塞,打开C火塞,在装有少量苯的三口烧瓶中由A口加入少量溴,再加入铁屑,塞住A口.
回答下列问题:
(1)D试管中装的是什么 , 其作用是 .
(2)E试管内装的是
(3)除去溴苯中混有的Br2杂质的试剂是 , 操作方法为 .
(4)三口烧瓶中发生反应的化学方程式为 , .
(5)根据什么现象可证明验证溴与苯的反应是取代反应? .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热△H=﹣57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(﹣57.3)kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+ ![]() O2(g)═CO2 (g);△H=﹣283.0kJ/mol
O2(g)═CO2 (g);△H=﹣283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol硫燃烧生成气态三氧化硫所放出的热量是硫磺的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、0族元素除外)( )

A. 4x B. 4x+6 C. 4x+10 D. 4x+14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发对二甲苯的绿色合成路线取得新进展,其合成示意图如下。
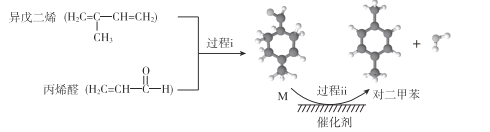
下列说法不正确的是
A. 过程i发生了加成反应
B. 中间产物M的结构简式为![]()
C. 利用相同原理以及相同原料,也能合成邻二甲苯和间二甲苯
D. 该合成路线理论上碳原子100%利用,最终得到的产物易分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学变化是有条件的。某小组同学探究I-与金属阳离子的氧化还原反应,实验过程如下。
已知同浓度的稀溶液中氧化性:Ag+>Fe3+>Cu2+。
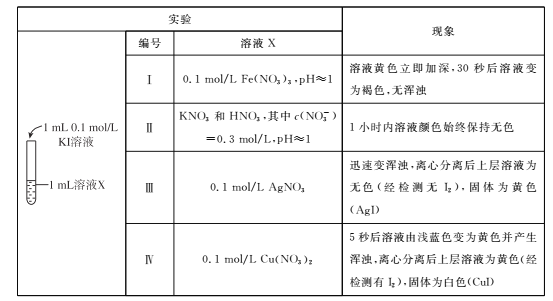
(1)根据实验I和Ⅱ,请回答下列问题。
①由“黄色立即加深”初步判断有I2生成,选择 ___(填试剂)进一步证实生成了I2。
②写出Fe3+与I-反应的离子方程式__,该条件下氧化性:Fe2+ __ I2(选填“>”或“<”)。
③实验Ⅱ的目的是____。
(2)实验Ⅳ中Cu2+与I-反应的离子方程式是___,甲同学得出氧化性:Cu2+ >I2。
(3)乙同学认为甲同学的结论不合理,分析原因:实验Ⅲ应有 I2生成,但却生成了AgI沉淀,因此推测实验Ⅳ中I2的生成,与Cul沉淀有关,故不能确定氧化性:Cu2+>I2,并用下图装置进行验证。

K闭合后,较长时间发现两侧溶液均无明显变化。乙同学为了进一步判断Cu2+和I2的氧化性强弱,将左侧电极改为Cu电极,并向右侧溶液中加入少量 ___(填试剂),发现指针偏转,且左侧溶液颜色加深,证明该条件下氧化性:Cu2+ __ I2(选填“>”或“<”)。
(4)该小组同学进一步分析认为,实验Ⅲ没有发生2Ag++ 2I-=2Ag+I2的反应,原因是生成AgI沉淀,反应物浓度迅速降低,不利于该反应进行;请分析实验Ⅳ发生氧化还原反应的原因是____。
(5)小组同学反思实验,反应体系中,各物质浓度对氧化还原反应是否发生都有一定的影响。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com