
【题目】下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热△H=﹣57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(﹣57.3)kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+ ![]() O2(g)═CO2 (g);△H=﹣283.0kJ/mol
O2(g)═CO2 (g);△H=﹣283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol硫燃烧生成气态三氧化硫所放出的热量是硫磺的燃烧热
【答案】B
【解析】解:A、中和热是强酸强碱的稀溶液反应生成1mol水放出的热量;H2SO4和Ca(OH)2反应生成硫酸钙微弱物,反应放出的热量大于2×(﹣57.3)kJ/mol;故A错误;
B、燃烧热是1mol可燃物质完全燃烧生成稳定氧化物时放出的热量;CO燃烧热的热化学方程式为CO(g)+ ![]() O2(g)═CO2 (g);△H=﹣283.0 kJ/mol;故B正确;
O2(g)═CO2 (g);△H=﹣283.0 kJ/mol;故B正确;
C、有些放热反应也需要一定条件才能发生反应;可燃物燃烧需要点燃,故C错误;
D、硫单质燃烧生成的是二氧化硫,不能生成三氧化硫;1 mol硫燃烧生成气态而氧化硫所放出的热量是硫磺的燃烧热,故D错误;
故选B.
【考点精析】通过灵活运用反应热和焓变,掌握在化学反应中放出或吸收的热量,通常叫反应热即可以解答此题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液滴加到H2X溶液中,混合溶液的pH与![]() 、
、![]() 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是

A. H2X为二元强酸
B. 当![]() =1时,溶液中c(HXˉ)=c(H2X)
=1时,溶液中c(HXˉ)=c(H2X)
C. NaHX溶液中c(H+)<c(OHˉ)
D. 当溶液pH=4.6时c(HXˉ)>c (X2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10﹣10 , 下列说法不正确的是( ) 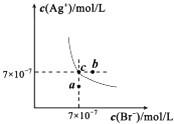
A.在t℃时,AgBr的Ksp为4.9×l0﹣13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t℃时,AgCl(s)+Br﹣(aq)AgBr(s)+Cl﹣(aq)平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2﹣二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18gcm﹣3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可以用下图所示装置制备1,2﹣二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水). 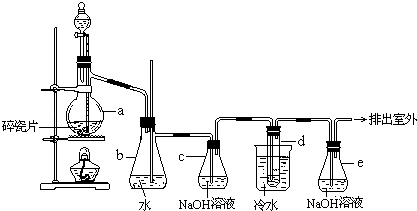
填写下列空白:
(1)写出本题中制备1,2﹣二溴乙烷的两个化学反应方程式.
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象. .
(3)容器c中NaOH溶液的作用是: .
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多.如果装置的气密性没有问题,试分析其可能的原因. .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中可以大量共存的一组是( )
A.K+、Na+、SO42-B.K+、H+、OH-
C.Na+、Ag+、Cl-D.Ca2+、OH-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容密闭容器中发生反应2A(g)+B(g)![]() 2C(g),若反应物A的浓度由0.1 mol·L-1降到0.06 mol·L-1需20 s,那么由0.06 mol·L-1降到0.036 mol·L-1所需的时间为( )
2C(g),若反应物A的浓度由0.1 mol·L-1降到0.06 mol·L-1需20 s,那么由0.06 mol·L-1降到0.036 mol·L-1所需的时间为( )
A. 等于10 s B. 等于12 s
C. 大于12 s D. 小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞主要化学成分的叙述中,不正确的是 ( )
A. 动物乳汁中的乳糖和植物细胞中的纤维素都属于多糖
B. 胆固醇、维生素D都属于脂质
C. 脱氧核糖核酸是染色体的主要成分之一
D. 蛋白质的多样性与氨基酸的种类、数目和排列顺序等有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:
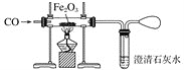
(1)写出得到单质铁的化学方程式:_________________________。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:______。
(3)装置末端气球的作用为_____________________________。实验结束时,应该先停止加热还是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:对于电离常数为Ka的某一元弱酸,pH突变随其浓度的增大而增大,且浓度主要影响滴定终点和滴定终点之后的曲线部分。常温下,用不同浓度的NaOH溶液分别滴定20mL与其同浓度的某弱酸HA溶液,滴定曲线如图所示。下列说法不正确的是
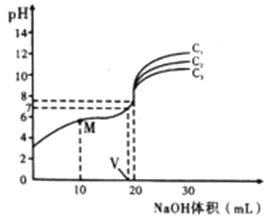
A. 由图可知:c1>c2>c3
B. M点溶液中存在:c(H+)+c(HA)=c(OHˉ)+c(Aˉ)
C. 恰好中和时,溶液中离子浓度的大小关系:c(Na+)>C(Aˉ ) >C(OHˉ )>c(H+)
D. 计算可知HA的电离常数:Ka=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com