
【题目】已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]﹣ , 铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法. 【方法一】还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬.具体流程如下:![]()
有关离子完全沉淀的pH如下表:
有关离子 | Fe2+ | Fe3+ | Cr3+ |
完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(1)写出Cr2O72﹣与FeSO4溶液在酸性条件下反应的离子方程式 .
(2)还原+6价铬还可选用以下的试剂(填序号).
A.明矾
B.铁屑
C.生石灰
D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4 , 再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.则在操作②中可用于调节溶液pH的试剂为:(填序号); A.Na2O2 B.Ba(OH)2 C.Ca(OH)2
此时调节溶液的pH范围在(填序号)最佳.
A.3~4 B.6~8 C.10~11 D.12~14
(4)【方法二】电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去. 写出阴极的电极反应式 .
(5)电解法中加入氯化钠的作用是: .
【答案】
(1)Cr2O72﹣+6Fe2++14H+═2 Cr3++6Fe3++7H2O
(2)BD
(3)B ;C
(4)2H++2e﹣═H2↑或2H2O+2e﹣═H2↑+2OH﹣
(5)增强溶液导电性
【解析】解:(1)二价铁离子有还原性,Cr2O72﹣有强氧化性,二者能发生氧化还原反应,二价铁离子被氧化成三价铁离子,Cr2O72﹣被还原为Cr3+,反应方程式为Cr2O72﹣+6Fe2++14H+═2 Cr3++6Fe3++7H2O,
所以答案是:Cr2O72﹣+6Fe2++14H+═2 Cr3++6Fe3++7H2O;(2)能还原+6价铬,说明加入的物质有还原性,且不能引进新的杂质离子,
A.明矾没有还原性,故错误;
B.铁屑能还原+6价铬,同时本身被氧化成三价铁离子,故正确;
C.生石灰没有还原性,故错误;
D.亚硫酸氢钠能还原+6价铬,同时本身被氧化成硫酸根离子,故正确;
所以答案是:BD;(3)A.Na2O2 有强氧化性,能把Cr3+氧化成Cr6+,从而得不到Cr(OH)3,故错误;
B.Ba(OH)2 和硫酸根离子能产生硫酸钡沉淀,生成杂质,故错误;
C.Ca(OH)2 使Fe3+和Cr3+产生氢氧化物沉淀,且没有其它沉淀杂质生成,故正确;
在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀,且没有氢氧化亚铁沉淀,所以溶液的PH应大于5.6小于9,所以B正确,
所以答案是:C; B;(4)将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解,阳极上铁失电子生成二价铁离子,阴极上氢离子得电子生成氢气,电极反应式为2H++2e﹣═H2↑或2H2O+2e﹣═H2↑+2OH﹣,
所以答案是:2H++2e﹣═H2↑或2H2O+2e﹣═H2↑+2OH﹣;(5)水是弱电解质,所以蒸馏水的导电能力很小,氯化钠是强电解质,在水中能完全电离导致溶液阴阳离子浓度增大,所以能增强溶液导电性;
所以答案是:增强溶液导电性.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】席夫碱主要是指含有亚胺或甲亚胺特性基团(-RC=N-)的一类有机化合物,常用作有机合成试剂和液晶材料。通常席夫碱是由胺和活性羰基缩合而成。某席夫碱类化合物G的一种合成路线如下:

已知以下信息
①
②lmol B经上述反应可生成2mol C,且C能发生银镜反应
③D属于单取代芳烃,其相对分子质量为92
④核磁共振氢谱显示F苯环上有两种化学环境的氢
⑤
回答下列问题
(1)由A生成B的化学方程式为_____________,反应类型为_______________。
(2)D的名称是____________,由D生成E的化学方程式为_______________。
(3)G的结构简式为_______________。
(4)C8H11N的同分异构体中含有苯环的共有_____种(不考虑立体异构),其中核磁共振氢谱为4组峰,且面积比为6:2:2:1的是___________(写出其中一种的结构简式)。
(5)上述合成路线,设计一条由苯及化合物C合成乙基苯胺(![]() )的合成路线:_________________________
)的合成路线:_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E 为原子序数依次增大的前四周期元素。已知前四种元素的基态原子p能级都有2个单电子,E 的原子序数等于A、B、C三种元素原子序数之和。
试回答下列问题:
(1)基态E原子外围电子排布图为_________;其中M 能层有_____种能量不同的电子。
(2)从原子结构角度解释B 电负性大于D的原因是:_______________。
(3) 含A元素的化合物中,A 的原子间常有π键,但是含C元素的化合物中,C的原子间只能存在σ键,其主要原因是___________________。
(4)H2D2B8是一种具有强氧化性的二元酸(其中分子结构中有2个B原子显-1价),则H2D2B8的结构式为___________,分子中采取sp3杂化的B原子有______个。
(5)E 晶胞内粒子的堆积模型如图所示。

已知:E 晶胞的密度为ρg/cm3,NA代表阿伏加德罗常数值,E 的相对原子质量为M。
①E 粒子的配位数为_______。
②E 粒子半径为_______pm。
③E 晶胞中粒子的空间利用率φ=_____(用含π 的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2 可广泛用于有机反应催化剂、污水处理剂等。实验室可用镁屑与液溴为原料,采用下图装置制备无水MgBr2,请回答:
(1)识别下图中仪器。A的名称是______,B是_______
(2)实验时,可向装置C中缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。干燥的氮气能将液溴吹出,因为液溴具有________的性质;实验中不能用干燥空气代替干燥N2,原因是:___________________________________________________________

(3)已知:Mg和Br2反应剧烈放热;乙醚(C2H5OC2H5)极易挥发。MgBr2和乙醚能发生如下反应:MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5+Q(Q>0);反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0°C,析出晶体,再过滤得三乙醚合溴化镁粗品。第一次过滤除去的物质是_______。过滤必须用到的玻璃仪器是:_______。
MgBr2·3C2H5OC2H5+Q(Q>0);反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0°C,析出晶体,再过滤得三乙醚合溴化镁粗品。第一次过滤除去的物质是_______。过滤必须用到的玻璃仪器是:_______。
(4)试用平衡移动的原理说明得到三乙醚合溴化镁后,加热有利于其分解,得无水MgBr2产品的原因: ______________________________
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:Mg2++Y4-====Mg Y2-
①滴定前润洗滴定管的操作方法是____________________________
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500mol/L的EDTA 标准溶液滴定至终点,消耗EDTA 标准溶液26.50mL,则测得无水MgBr2产品的纯度是___________ (以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,某些建筑材料会产生放射性同位素氡22286Rn,从而对人体产生危害。该同位素原子的中子数和质子数之差为( )
A.136B.50C.86D.222
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液滴加到H2X溶液中,混合溶液的pH与![]() 、
、![]() 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是

A. H2X为二元强酸
B. 当![]() =1时,溶液中c(HXˉ)=c(H2X)
=1时,溶液中c(HXˉ)=c(H2X)
C. NaHX溶液中c(H+)<c(OHˉ)
D. 当溶液pH=4.6时c(HXˉ)>c (X2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五水硫酸铜(CuSO4·5H2O)和六水硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]都是重要的化工原料,用途十分广泛。
请回答与这两种物质中元素有关的一些问题。
(1)基态铁原子的核外电子排布式为_______;基态铜原子的电子占据的最高能层符号为_______ 。
(2)氧元素的第一电离能小于氮元素,其原因是_______ 。
(3)SO42-、H2O、NH4+三种微粒中,空间构型为正四面体的是_______;NH4+中氮原子的杂化轨道类型是_______。
(4)写出与SO42-互为等电子体的分子的化学式_______ (写一种)。
(5)Cu与Au的合金可形成面心立方最密堆积的晶体,在该晶胞中Cu原子处于面心,该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为_______,若该晶体的密度为ρg.cm-3,则晶胞中Cu原子与Au原子中心的最短距离d=_______cm(NA表示阿伏加德罗常数的值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N和Si能形成多种高硬度材料,如Si3N4,C3N4,SiC.
(1)Si3N4和C3N4中硬度较高的是______,理由是_________.
(2)C和N能形成一种类石墨结构材料,其合成过程如下图所示。该类石墨结构材料化合物的化学式为_________。其合成过程中有三聚氰胺形成,三聚氰胺中N原子的杂化方式有_____________。

(3)C和N还能形成一种五元环状有机物咪唑(im),其结构为![]() 。化合物[Co(im)6]SiF6的结构示意图如下:
。化合物[Co(im)6]SiF6的结构示意图如下:
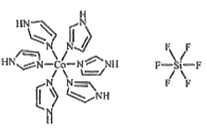
①Co原子的价层电子轨道表达式(价层电子排布图)为_____。N与Co之间的化学键类型是___,判断的理由是__________。
②阴离子SiF62-中心原子Si的价层电子对数为______。阳离子(Co(im)6]2+和SiF62-之间除了阴阳离子间的静电作用力,还存在氢键作用,画出该氢键的表示式_______。
例如水中氢键的表示式为: ![]()
(4)SiC为立方晶系晶体,晶胞參数为a,已知Si原子半径为rSi,C原子半径为rC,该晶胞中原子的分数坐标为:

则SiC立方晶胞中含有____个Si原子、____个C原子,该晶胞中原子的体积占晶胞体积的百分率为__________(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中可以大量共存的一组是( )
A.K+、Na+、SO42-B.K+、H+、OH-
C.Na+、Ag+、Cl-D.Ca2+、OH-、CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com