
【题目】席夫碱主要是指含有亚胺或甲亚胺特性基团(-RC=N-)的一类有机化合物,常用作有机合成试剂和液晶材料。通常席夫碱是由胺和活性羰基缩合而成。某席夫碱类化合物G的一种合成路线如下:

已知以下信息
①
②lmol B经上述反应可生成2mol C,且C能发生银镜反应
③D属于单取代芳烃,其相对分子质量为92
④核磁共振氢谱显示F苯环上有两种化学环境的氢
⑤
回答下列问题
(1)由A生成B的化学方程式为_____________,反应类型为_______________。
(2)D的名称是____________,由D生成E的化学方程式为_______________。
(3)G的结构简式为_______________。
(4)C8H11N的同分异构体中含有苯环的共有_____种(不考虑立体异构),其中核磁共振氢谱为4组峰,且面积比为6:2:2:1的是___________(写出其中一种的结构简式)。
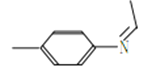
(5)上述合成路线,设计一条由苯及化合物C合成乙基苯胺(![]() )的合成路线:_________________________
)的合成路线:_________________________
【答案】 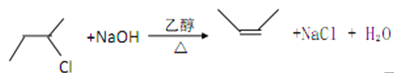 消去反应 甲苯
消去反应 甲苯 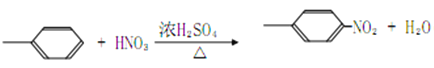
 20
20 ![]() 或
或 或
或
【解析】A的分子式为C4H9Cl,为丁烷的一氯代物,在氢氧化钠的醇溶液、加热条件下发生消去反应得到B为烯烃,1mol B发生信息①中氧化反应生成2mol C,且C能发生银镜反应,B为对称结构烯烃,且不饱和C原子有H原子,故B为CH3CH=CHCH3,C为CH3CHO,逆推可知A为CH3CH2-CHClCH3。D属于单取代芳烃,其相对分子质量为92,D含有一个苯环,侧链式量=92-77=15,故侧链为-CH3,D为![]() ,核磁共振氢谱显示F苯环上有两种化学环境的氢,故D发生乙基对位取代反应生成E为
,核磁共振氢谱显示F苯环上有两种化学环境的氢,故D发生乙基对位取代反应生成E为![]() ,由F的分子式可知,E中硝基被还原为-NH2,则F为
,由F的分子式可知,E中硝基被还原为-NH2,则F为![]() ,C与F发生信息⑤中反应,分子间脱去1分子水形成N=C双键得到G,则G为
,C与F发生信息⑤中反应,分子间脱去1分子水形成N=C双键得到G,则G为![]() 。
。
(1)由A生成B的化学方程式为:CH3CH2-CHClCH3+NaOH![]() CH3CH=CHCH3+NaCl+H2O,属于消去反应,故答案为:CH3CH2-CHClCH3+NaOH
CH3CH=CHCH3+NaCl+H2O,属于消去反应,故答案为:CH3CH2-CHClCH3+NaOH![]() CH3CH=CHCH3+NaCl+H2O;消去反应;
CH3CH=CHCH3+NaCl+H2O;消去反应;
(2)由上述分析可知,D为![]() ,化学名称是甲苯,由D生成E的化学方程式为:
,化学名称是甲苯,由D生成E的化学方程式为:![]() +HO-NO2
+HO-NO2![]()
![]() +H2O,故答案为:甲苯;
+H2O,故答案为:甲苯;![]() +HO-NO2
+HO-NO2![]()
![]() +H2O;
+H2O;
(3)由上述分析可知,G的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
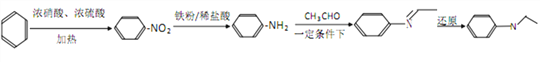
(4)C8H11N的同分异构体中含有苯环,若取代基为氨基、乙基,还有邻位、间位、对位3种,若只有一个取代基,可以为-CH(NH2)CH3、-CH2CH2NH2、-NH-CH2CH3、-CH2NHCH3、-N(CH3)2,有5种;若取代为2个,还有-CH3、-CH2NH2或-CH3、-NHCH3,各有邻、间、对三种,共有6种;若取代基有3个,即-CH3、-CH3、-NH2,2个甲基相邻,氨基有2种位置,2个甲基处于间位,氨基有3种位置,2个甲基处于对位,氨基有1种位置,共有2+3+1=6种,故符合条件的同分异构体有:3+5+6+6=20,其中核磁共振氢谱为4组峰,且面积比为6:2:2:1,说明含有2个-CH3,可以是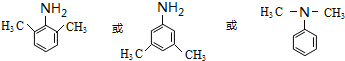 ,故答案为:20;
,故答案为:20; ;
;
(5)由苯与浓硝酸、浓硫酸在加热条件下得到硝基苯,硝基苯在Fe粉/盐酸条件下还有得到I为![]() ,再与CH3CHO反应得到
,再与CH3CHO反应得到![]() ,最后与氢气加成得到
,最后与氢气加成得到![]() ,
,
故合成路线为![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】下图为某实验小组制取乙酸乙酯的实验装置图,烧瓶中盛有乙醇和浓H2SO4。反应时,将乙酸从分液漏斗滴入烧瓶中即可。

①为方便研究酯化反应的过程,乙醇中的氧原子用18O进行了标记(即C2H518OH),请用氧的同位素示踪法写出乙酸与乙醇发生酯化反应的化学方程式: 。
②装置A的名称是 ,使用时要先从 口(填“a”或“b”)进水。
③实验结束后,锥形瓶中收集到乙酸乙酯、乙醇和乙酸的混合液。为了将这三者进行分离,该小组依如下流程进行了进一步的实验:

试剂(a)是 ,试剂(b)是 ,
分离方法(1)是 ,分离方法(2)是 ,分离方法(3)是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“观察DNA和RNA在细胞中的分布”实验中,将口腔上皮细胞置入8﹪的盐酸溶液中水解的目的是( )
A. 使细胞中的DNA水解成脱氧核苷酸
B. 使细胞中物质全部水解
C. 利用盐酸改变细胞壁的通透性,加速染色剂进入细胞
D. 使染色体中的DNA与蛋白质分离,有利于蛋白质与染色剂结合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1℃时,在四个容积均为1L的恒容密闭容器中发生反应:2NO(g)+2H2(g)![]() N2(g)+2H2O(g) ΔH,该反应的速率表达式为v=k·cm(NO)·cn(H2)(k、m、n为常数),测得有关实验数据如下:
N2(g)+2H2O(g) ΔH,该反应的速率表达式为v=k·cm(NO)·cn(H2)(k、m、n为常数),测得有关实验数据如下:
容器编号 | 物质的起始浓度/(mol/L) | 速率/(mol·L-1·s-1) | 物质的平衡浓度/(mol/L) | |
c(NO) | c(H2) | c(N2) | ||
Ⅰ | 6×10-3 | 1×10-3 | a×10-3 | 2×10-4 |
Ⅱ | 6×10-3 | 2×10-3 | 2a×10-3 | |
Ⅲ | 1×10-3 | 6×10-3 | b×10-3 | |
Ⅳ | 2×10-3 | 6×10-3 | 4b×10-3 | |
下列说法正确的是( )
A. m=2,n=2
B. 达到平衡时,容器Ⅱ与容器Ⅳ的总压强之比为1:2
C. 温度升高为T2℃,测得平衡时,容器Ⅱ中c(H2O)=3.8×10-4mol/L,则ΔH>0
D. T1℃时,容器Ⅲ中达到平衡后再充入NO、H2O(g)各2×10-4mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同条件下,一定量的氢气在氧气中充分燃烧并放出热量。若生成液态水放出的热量为Q1 kJ;若生成气态水放出的热量为Q2 kJ,那么Q1与Q2的大小关系是
A.Q1>Q2 B.Q1<Q2 C.Q1=Q2 D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下两个反应:(A)NaOH+HCl===NaCl+H2O (B)2FeCl3+Cu===2FeCl2+CuCl2
(1)根据两反应本质,判断能否设计成原电池(填“能”或“不能”)(A)______,(B)________;
(2)如果(A或B)不能,说明其原因_________________________________________;
(3)如果(A或B)可以,则在下面方框中画出装置图并写出正、负极材料及电极反应式
________
负极:________、_______________________________________;
正极:________、________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(34Se)与氧同主族,硒元素及其化合物与人体健康、工业生产密切相关。某科研小组以阳极泥(主要成分是Se,含有CuSe、Ag2Se等杂质)为原料,提炼硒的流程如下:

请回答下列问题:
(1)硒原子的次外层电子数_______,与硒同周期相邻元素是________(填元素名称)。
(2)已知A是Na2SeO3,可用于治疗克山病,则A的化学名称为______;C是Na2Se,则Na2Se的电子式为_______。
(3)上述流程图中的括号内“( )”,按操作先后顺序依次填写的内容是_____、_____。
(4)写出高温下用焦炭还原B的化学方程式___________________。
(5)溶液C中析出硒的离子方程式____________________。
(6)向Na2SeO3溶液中滴加稍过量的乙酸,其离子方程式为__________________。已知:Ka1(H2SeO3)=2.7×10-3、Ka2(H2SeO3)=2.5×10-8、Ka(CH3COOH)=1.8×10-5。
(7)粗硒可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示:

蒸馏操作中控制的最佳温度是________(填标号)。
A.455℃ B.462℃ C.475℃ D.515℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]﹣ , 铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法. 【方法一】还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬.具体流程如下:![]()
有关离子完全沉淀的pH如下表:
有关离子 | Fe2+ | Fe3+ | Cr3+ |
完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(1)写出Cr2O72﹣与FeSO4溶液在酸性条件下反应的离子方程式 .
(2)还原+6价铬还可选用以下的试剂(填序号).
A.明矾
B.铁屑
C.生石灰
D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4 , 再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.则在操作②中可用于调节溶液pH的试剂为:(填序号); A.Na2O2 B.Ba(OH)2 C.Ca(OH)2
此时调节溶液的pH范围在(填序号)最佳.
A.3~4 B.6~8 C.10~11 D.12~14
(4)【方法二】电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去. 写出阴极的电极反应式 .
(5)电解法中加入氯化钠的作用是: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com