
【题目】高锰酸钾是中学常用的试剂。工业上用软锰矿制备高锰酸钾流程如下。
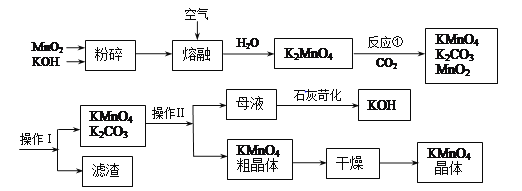
(1)铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式__________。
(2)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是________(填代号)。
a.84消毒液(NaClO溶液) b.双氧水 c.75%酒精 d.肥皂水
(3)上述流程中可以循环使用的物质有________、________(写化学式)。
(4)理论上(若不考虑物质循环与制备过程中的损失)1molMnO2可制得________molKMnO4。
(5)操作Ⅰ的名称是________;操作Ⅱ根据KMnO4和K2CO3两物质在溶解度上的差异,采用________(填操作步骤)、趁热过滤得到KMnO4粗晶体。
【答案】 2Mn2++5NaBiO3+14H+=2MnO4-+5Bi3++5Na++7H2O ab MnO2 KOH ![]() 过滤 蒸发结晶(或浓缩结晶)
过滤 蒸发结晶(或浓缩结晶)
【解析】分析:二氧化锰与氢氧化钾在空气中熔融,加水溶计算得出到K2MnO4溶液,通入二氧化碳得到KMnO4、MnO2、K2CO3,过滤除去滤渣(MnO2),滤液为KMnO4、K2CO3溶液,浓缩结晶,趁热过滤得到KMnO4晶体,滤液中含有K2CO3,在滤液中加氢氧化钙得到碳酸钙沉淀和KOH,以此解答。
(1)铋酸钠(不溶于水)在酸性溶液中与Mn2+反应生成MnO42-和Bi3+,则反应的离子方程式为: 2Mn2++5NaBiO3+14H+=2MnO4-+5Bi3++5Na++7H2O;
因此,本题正确答案是: 2Mn2++5NaBiO3+14H+=2MnO4-+5Bi3++5Na++7H2O;
(2) KMnO4有强氧化性,利用其强氧化性杀菌消毒,消毒原理与84消毒液、双氧水一样,因此,本题正确答案是:ab;
(3)根据流程分析可以知道:在开始的反应物和最终的生成物中都含有MnO2和KOH,所以二氧化锰和氢氧化钾能循环使用;
因此,本题正确答案是: MnO2;KOH;
(4)由2MnO2+4KOH+O2==2K2MnO4+2H2O可以知道最初的原料中1molMnO2恰好得到1molK2MnO4。由3K2MnO4+2CO2==2KMnO4+2K2CO3+MnO2知, 1molK2MnO4在反应中能得到![]() molKMnO4,
molKMnO4,
因此,本题正确答案是:![]() ;
;
(5)该操作是分离固体与溶液,是过滤操作, KMnO4和K2CO3在溶解性上不同,采用热的情况下用浓缩结晶的方式可分离,
因此,本题正确答案是: 过滤;蒸发结晶(或浓缩结晶)。


科目:高中化学 来源: 题型:
【题目】某课外研究性学习小组用如图所示装置制备少量溴苯并验证溴与苯的反应是取代反应. 
实验时,关闭F火塞,打开C火塞,在装有少量苯的三口烧瓶中由A口加入少量溴,再加入铁屑,塞住A口.
回答下列问题:
(1)D试管中装的是什么 , 其作用是 .
(2)E试管内装的是
(3)除去溴苯中混有的Br2杂质的试剂是 , 操作方法为 .
(4)三口烧瓶中发生反应的化学方程式为 , .
(5)根据什么现象可证明验证溴与苯的反应是取代反应? .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成药物中间体M的流程图如下。

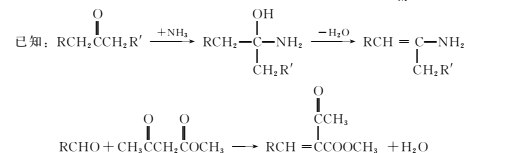
(1)芳香烃A的核磁共振氢谱有 ___种峰。
(2)在一定条件下,步骤②的化学方程式是____。
(3)步骤③反应物C含有官能团的名称是氨基、____。
(4)步骤④⑤⑥中,属于取代反应的是 ___(填序号)。
(5)步骤⑥可得到一种与G分子式相同的有机物,将其结构简式补充完整:____________
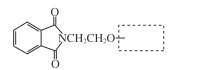
(6)H的结构简式是____。
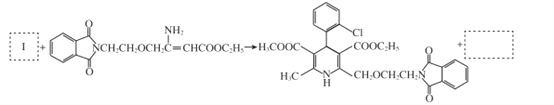
(7)将步骤⑧中合成M的化学方程式补充完整:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是( )

A. 形成锌-铜原电池 B. 实验室制备乙酸乙酯
C. 证明酸性:CHCOOH>H2CO3>硅酸 D. 石油的分馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从海带灰中提取碘的操作过程中仪器选用不正确的是
A. 称取3 g左右的干海带——托盘天平
B. 灼烧干海带至完全变成灰烬——蒸发皿或坩埚
C. 过滤煮沸后的海带灰和水的混合物——漏斗
D. 用四氯化碳从氧化后的海带灰浸取液中提取碘——蒸馏烧瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学变化是有条件的。某小组同学探究I-与金属阳离子的氧化还原反应,实验过程如下。
已知同浓度的稀溶液中氧化性:Ag+>Fe3+>Cu2+。
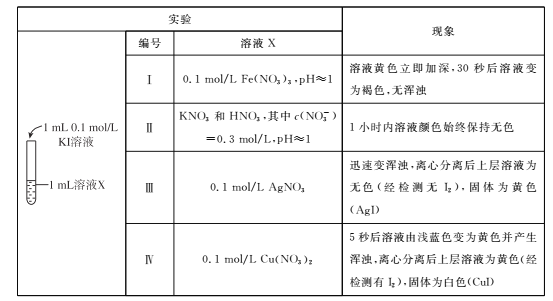
(1)根据实验I和Ⅱ,请回答下列问题。
①由“黄色立即加深”初步判断有I2生成,选择 ___(填试剂)进一步证实生成了I2。
②写出Fe3+与I-反应的离子方程式__,该条件下氧化性:Fe2+ __ I2(选填“>”或“<”)。
③实验Ⅱ的目的是____。
(2)实验Ⅳ中Cu2+与I-反应的离子方程式是___,甲同学得出氧化性:Cu2+ >I2。
(3)乙同学认为甲同学的结论不合理,分析原因:实验Ⅲ应有 I2生成,但却生成了AgI沉淀,因此推测实验Ⅳ中I2的生成,与Cul沉淀有关,故不能确定氧化性:Cu2+>I2,并用下图装置进行验证。

K闭合后,较长时间发现两侧溶液均无明显变化。乙同学为了进一步判断Cu2+和I2的氧化性强弱,将左侧电极改为Cu电极,并向右侧溶液中加入少量 ___(填试剂),发现指针偏转,且左侧溶液颜色加深,证明该条件下氧化性:Cu2+ __ I2(选填“>”或“<”)。
(4)该小组同学进一步分析认为,实验Ⅲ没有发生2Ag++ 2I-=2Ag+I2的反应,原因是生成AgI沉淀,反应物浓度迅速降低,不利于该反应进行;请分析实验Ⅳ发生氧化还原反应的原因是____。
(5)小组同学反思实验,反应体系中,各物质浓度对氧化还原反应是否发生都有一定的影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,2012年俄罗斯科学家再次合成117号元素。本次实验生成了6个新原子,其中5个![]() ,1个
,1个![]() 。下列关于
。下列关于![]() 和
和![]() 的说法不正确的是
的说法不正确的是
A. 是元素X的两种不同核素 B. 电子数相差1
C. 中子数分别为176和177 D. 它们互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某学习小组设计如下图装置制取SO2,研究其性质,并进一步探究不同浓度硫酸的氧化性

请回答下列问题:
(1)B、C、D分别用于检验SO2的性质,写出C中反应的离子方程式________________。
(2)实验中观察到D中有浑浊出现,有同学提出此现象不能证明SO2具有氧化性。
请简述理由:______________________________________________。
(3)E装置的作用为_____________________________。
Ⅱ.某学习小组设计并完成如下实验:称取一定量的还原铁粉放入一定体积的浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。经检验,气体Y中含有SO2、H2。
(4)溶液X中一定大量含有的金属阳离子是___________,简述如何检验溶液X中该离子______________________。
(5)为了测定气体Y中SO2的含量,将2.24L(标准状况)气体Y通入到200.00mL 0.2000mol/L酸性高锰酸钾溶液中,充分反应后,取出20.00mL溶液转入锥形瓶中进行滴定,消耗浓度为0.0500mol/L的KHC2O4标准液20.00mL。
①室温下,0.05mol/L KHC2O4溶液中,c(C2O42-)>c(H2C2O4)。滴定操作时,标准液应装在
___________(填仪器名称)中;滴定终点的现象为______________________________。
②气体Y中SO2的物质的量分数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表部分短周期元素信息,判断以下叙述正确的是( )
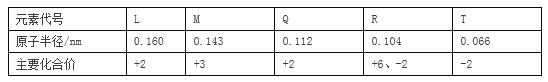
A. 氢化物的沸点为H2T<H2R B. 单质与稀盐酸反应的剧烈程度L<Q
C. M与T形成的化合物具有两性 D. L2+与R2﹣的核外电子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com