
【题目】合成药物中间体M的流程图如下。

(1)芳香烃A的核磁共振氢谱有 ___种峰。
(2)在一定条件下,步骤②的化学方程式是____。
(3)步骤③反应物C含有官能团的名称是氨基、____。
(4)步骤④⑤⑥中,属于取代反应的是 ___(填序号)。
(5)步骤⑥可得到一种与G分子式相同的有机物,将其结构简式补充完整:____________
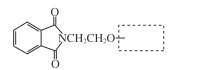
(6)H的结构简式是____。
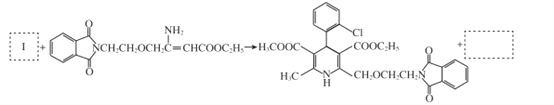
(7)将步骤⑧中合成M的化学方程式补充完整:________
【答案】 3 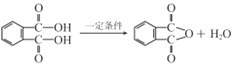 羟基 ④
羟基 ④ ![]()
![]()
 、H2O
、H2O
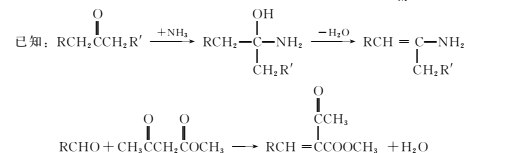
【解析】(1)由D的分子结构可以推得芳香烃A为邻二甲苯,共有三种等效氢,所以核磁共振氢谱有3种峰。
(2)A为![]() 被氧化后甲基变成羧基成为邻苯二甲酸,邻苯二甲酸中的两个羧基发生分子内脱水形成酸酐D,故方程式为
被氧化后甲基变成羧基成为邻苯二甲酸,邻苯二甲酸中的两个羧基发生分子内脱水形成酸酐D,故方程式为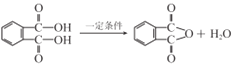 。
。
(3)根据C的结构简式,C中的官能团是氨基和羟基。
(4)从流程图中可以看出来,步骤④的反应是两个分子中的氯原子和羟基上的氢结合,属于取代反应,根据题中已知信息可知,步骤⑤是加成反应,⑥是消去反应,只有④是取代反应。
(5)羟基能够和羟基碳相邻的C原子上的氢原子发生消去反应,步骤⑥是和右边碳上的氢消去,也可以和左边碳上的氢原子发生消去反应,所以补充的另一种产物的结构简式就是![]() 。
。
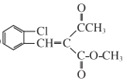
(6)根据M与G的结构简式,可以推出I的结构简式为: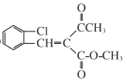 ,从而确定,反应
,从而确定,反应![]() 与已知信息2是同种反应类型,确定H的结构中必有醛基,且根据M确定,Cl原子与醛基为邻位关系,故可以推知H的结构简式为
与已知信息2是同种反应类型,确定H的结构中必有醛基,且根据M确定,Cl原子与醛基为邻位关系,故可以推知H的结构简式为![]() 。
。
(7)根据题中已知信息1,可知,I与G的反应是氨基与I中羰基发生加成反应后再脱水形成M,所以步骤⑧的另一个产物是H2O。


科目:高中化学 来源: 题型:
【题目】下面是某校化学研究性学习小组探究的过量的Fe与浓硫酸反应的实验:
I.甲同学设计如下实验反应得到的混合气体中含有SO2、H2、H2O

己知:CaSO3受热易分解
(1)写出过量Fe粉与浓硫酸反应产生等体积的SO2与H2的总化学方程式:________。
(2)若按气体从左到右的流向,为达到实验目的,各装置连接顺序是A→______(不可重复使用)。
(3)A中导管的作用为______,装置E中的干燥管中盛放的物质为碱石灰,其作用是________。
(4)证明有H2存在的实验现象是_________。
II.为测定混合气体中SO2的体积分数,,乙同学设计了如下实验方案:

(5) W溶液可以是下列溶液中的______(填字母代号);
A.H2O2溶液 B.NaOH溶液 C.KMnO4溶液(硫酸酸化) D.氯水
该混合气体中二氧化硫的体积分数为_______(用含V、m的代数式表示)。
(6)丙同学使用cmol/LxmLI2的淀粉溶液(过量)吸收混合气体,充分反应后,用0.1000mol/L的Na2S2O3标准溶液去滴定I2的淀粉溶液,达到滴定终点时消耗Na2S2O3的体积为20mL,该混合气体中二氧化硫的体积分数为______(用含V、c、x的代数式表示)[已知:I2+2S2O32-=2I-+S4O62-]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25 ℃饱和石灰水的烧杯中,试管中开始放入几小块镁条,再滴入5 mL的稀盐酸。
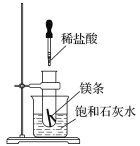
回答下列问题:
(1)实验中观察到的现象是____________________________________________。
(2)产生上述现象的原因是_________________________________________________。
(3)写出有关反应的离子方程式_________________________________________。
(4)由实验推知,MgCl2溶液和H2的总能量______(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础] A为某种聚甲基丙烯酸酯的单体,其转化关系如下:

己知:E、G的苯环上一氯代物只有两种:
II.RCH=CH2+HBr![]() RCH2CH2Br
RCH2CH2Br
请按要求回答下列问题:
(1)A的结构简式为______, ②的反应类型_____________。
(2)B中官能团的结构为_____________,H的名称____________。
(3)D可以发生缩聚反应,反应的化学方程式为____________。
(4)写出同时满足下列条件的G的同分异构体有_______种
①能发生银镜反应 ②苯环上的一氯取代物有两种
其中核磁共振氢谱峰面积之比为l:2:2:2:l,且遇FeCl3溶液显紫色的化合物的结构简式为______
(5)以B为原料合成含六元环的酯类物质,请设计合成路线(用流程图表示,无机试剂任选)。合成流程图示例如下:![]() ____
____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入N2和H2 , 在一定条件下使反应N2(g)+3H2(g)2NH3(g)△H<0达到平衡,n(NH3)和n(H2)随时间变化的关系如图所示.下列有关叙述正确的是( ) 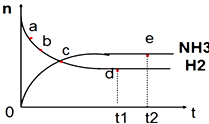
A.c点表示NH3生成速率与NH3分解速率相同
B.c点和e点时反应的平衡常数相同
C.N2的转化率:b>a
D.d点时,n(N2):n(H2):n(NH3)=1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于构成生物体的化学元素和化合物的叙述中,正确的是
A. 蛋白质结构多样性取决于氨基酸的种类、数量、排列顺序和空间结构
B. 青蛙和玉米细胞中的化学元素在种类和含量上基本相同
C. Mg是植物体中各色素分子必不可少的组成元素
D. C、H、O、N是组成生物体的基本元素,其中C是最基本元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于吸热反应同时又是氧化还原反应的是( )
A. 灼热的炭与CO2反应 B. 铝与稀盐酸
C. Ba(OH)2·8H2O与NH4Cl反应 D. Na2O2与H2O的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是中学常用的试剂。工业上用软锰矿制备高锰酸钾流程如下。
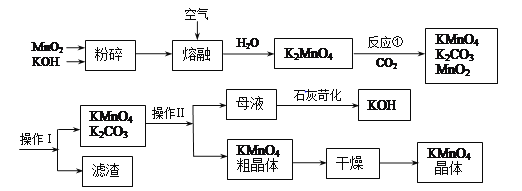
(1)铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式__________。
(2)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是________(填代号)。
a.84消毒液(NaClO溶液) b.双氧水 c.75%酒精 d.肥皂水
(3)上述流程中可以循环使用的物质有________、________(写化学式)。
(4)理论上(若不考虑物质循环与制备过程中的损失)1molMnO2可制得________molKMnO4。
(5)操作Ⅰ的名称是________;操作Ⅱ根据KMnO4和K2CO3两物质在溶解度上的差异,采用________(填操作步骤)、趁热过滤得到KMnO4粗晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是稀硫酸与某金属反应的实验数据:
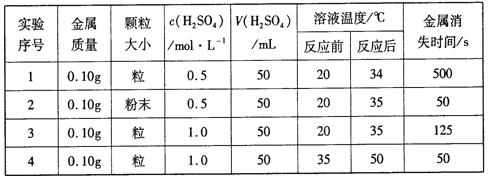
分析上述数据,回答下列问题:
(1)实验1和2表明,_____对反应速率有影响;实验1和3表明,______对反应速率与影响。
(2)室温下,将完全相同的锌片分别投入100mL0.1mol/L的稀硫酸和100mL0.2mol/L的稀盐酸中,仔细观察后发现,两者反应速率有明显差异:投入到稀硫酸中的锌表面产生的气泡没有投入到稀盐酸中的快。经分析讨论大家认为产生这一现象的原因有两种可能:
a、氯离子对反应起了促进作用,即氯离子加快了反应的进行;
b、____(你的观点)。
要证明你的观点,可以在室温下,分别取100mL0.1mol/L的盐酸溶液于两个相同的烧杯中,一个烧杯中加一定量的____固体(填所加试剂化学式),另一个烧杯作对比实验,再分别同时加入完全相同的锌片,比较两烧杯中反应速率的大小。
(3)在用锌粒和稀硫酸反应制取氢气时,往往加人少量CuSO4粉末,可加快产生H2的速率,其原因是_________(用文字表达)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com