
【题目】下表是稀硫酸与某金属反应的实验数据:
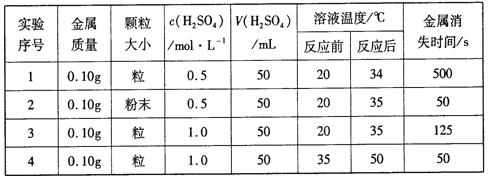
分析上述数据,回答下列问题:
(1)实验1和2表明,_____对反应速率有影响;实验1和3表明,______对反应速率与影响。
(2)室温下,将完全相同的锌片分别投入100mL0.1mol/L的稀硫酸和100mL0.2mol/L的稀盐酸中,仔细观察后发现,两者反应速率有明显差异:投入到稀硫酸中的锌表面产生的气泡没有投入到稀盐酸中的快。经分析讨论大家认为产生这一现象的原因有两种可能:
a、氯离子对反应起了促进作用,即氯离子加快了反应的进行;
b、____(你的观点)。
要证明你的观点,可以在室温下,分别取100mL0.1mol/L的盐酸溶液于两个相同的烧杯中,一个烧杯中加一定量的____固体(填所加试剂化学式),另一个烧杯作对比实验,再分别同时加入完全相同的锌片,比较两烧杯中反应速率的大小。
(3)在用锌粒和稀硫酸反应制取氢气时,往往加人少量CuSO4粉末,可加快产生H2的速率,其原因是_________(用文字表达)。
【答案】 固体的表面积 反应物浓度 SO42-离子对反应起抑制作用 Na2SO4 锌置换出铜,附在锌表面,在酸中形成铜锌原电池,加快反应速率
【解析】(1)其它条件相同,分析固体的表面积、反应物浓度对反应速率的影响规律。
(2)溶液中含有同浓度的氢离子,但是阴离子种类不同,探究阴离子对反应速率的影响的规律。
(3)锌铜和硫酸构成原电池,能够加快反应的速率。
(1)实验1和2中金属的状态不同,其它条件几乎相同,表明固体反应物的表面积对反应速率有影响,而且表面积越大,则反应速率越快;实验1和3中只有反应物的浓度不同,其它条件几乎相同,根据实验1和3可知,反应物浓度对反应速率产生影响,且浓度越大,反应速率越快;正确答案:固体的表面积;反应物浓度。
(2)100mL0.1mol/L的稀硫酸和100mL0.2mol/L的稀盐酸,两溶液中氢离子的浓度相同,但是阴离子不同,因此a、氯离子对反应起了促进作用,即氯离子加快了反应的进行;b、SO42-离子对反应起抑制作用;要证明上述观点,可以在室温下,分别取100mL0.1mol/L的盐酸溶液于两个相同的烧杯中,一个烧杯中加一定量的硫酸钠固体,另一个烧杯作对比实验,再分别同时加入完全相同的锌片,比较两烧杯中反应速率的大小,证明得出的结论;正确答案:SO42-离子对反应起抑制作用; Na2SO4 。
(3)在用锌粒和稀硫酸反应制取氢气时,往往加人少量CuSO4粉末,锌置换出铜,附在锌表面,在酸中形成铜锌原电池,加快反应速率;正确答案:锌置换出铜,附在锌表面,在酸中形成铜锌原电池,加快反应速率。


科目:高中化学 来源: 题型:
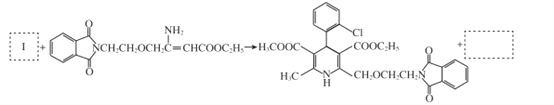
【题目】合成药物中间体M的流程图如下。

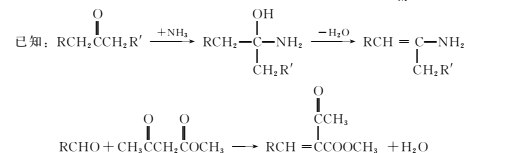
(1)芳香烃A的核磁共振氢谱有 ___种峰。
(2)在一定条件下,步骤②的化学方程式是____。
(3)步骤③反应物C含有官能团的名称是氨基、____。
(4)步骤④⑤⑥中,属于取代反应的是 ___(填序号)。
(5)步骤⑥可得到一种与G分子式相同的有机物,将其结构简式补充完整:____________
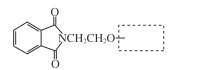
(6)H的结构简式是____。
(7)将步骤⑧中合成M的化学方程式补充完整:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,2012年俄罗斯科学家再次合成117号元素。本次实验生成了6个新原子,其中5个![]() ,1个
,1个![]() 。下列关于
。下列关于![]() 和
和![]() 的说法不正确的是
的说法不正确的是
A. 是元素X的两种不同核素 B. 电子数相差1
C. 中子数分别为176和177 D. 它们互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某学习小组设计如下图装置制取SO2,研究其性质,并进一步探究不同浓度硫酸的氧化性

请回答下列问题:
(1)B、C、D分别用于检验SO2的性质,写出C中反应的离子方程式________________。
(2)实验中观察到D中有浑浊出现,有同学提出此现象不能证明SO2具有氧化性。
请简述理由:______________________________________________。
(3)E装置的作用为_____________________________。
Ⅱ.某学习小组设计并完成如下实验:称取一定量的还原铁粉放入一定体积的浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。经检验,气体Y中含有SO2、H2。
(4)溶液X中一定大量含有的金属阳离子是___________,简述如何检验溶液X中该离子______________________。
(5)为了测定气体Y中SO2的含量,将2.24L(标准状况)气体Y通入到200.00mL 0.2000mol/L酸性高锰酸钾溶液中,充分反应后,取出20.00mL溶液转入锥形瓶中进行滴定,消耗浓度为0.0500mol/L的KHC2O4标准液20.00mL。
①室温下,0.05mol/L KHC2O4溶液中,c(C2O42-)>c(H2C2O4)。滴定操作时,标准液应装在
___________(填仪器名称)中;滴定终点的现象为______________________________。
②气体Y中SO2的物质的量分数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物仅由C,H,O三种元素组成,其相对分子量小于150,若其中氧的质量分数为百分之50,则分子中C原子个数最多为( )
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在标准状况下,气体摩尔体积约为22.4L/mol。则在常温常压下(25℃,101kPa)0.2mol气体A的体积为 ( )
A.4.48LB.大于4.48LC.小于4.48LD.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g)2SO3(g)△H<0,某研究小组探究其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是( ) 
A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高
D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表部分短周期元素信息,判断以下叙述正确的是( )
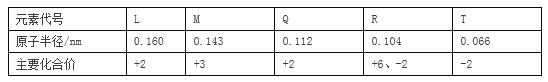
A. 氢化物的沸点为H2T<H2R B. 单质与稀盐酸反应的剧烈程度L<Q
C. M与T形成的化合物具有两性 D. L2+与R2﹣的核外电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:
(1)25℃时,将pH=12的NaOH溶液100mL,要使溶液pH降为11,需加入水的体积为:
(2)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,a与b应满足的关系是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com