
����Ŀ�����ݻ�������ܱ������д������·�Ӧ2SO2��g��+O2��g��2SO3��g����H��0��ij�о�С��̽�����������²���ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ���ǣ������� 
A.ͼ���ʾ����t1ʱ������O2��Ũ�ȶԷ�Ӧ���ʵ�Ӱ��
B.ͼ���ʾ����t1ʱ�̼��������Է�Ӧ���ʵ�Ӱ��
C.ͼ���ʾ���Ǵ�����ƽ���Ӱ�죬�ҼĴ�Ч�ʱ��ҵĸ�
D.ͼ���ʾ����ѹǿ�Ի�ѧƽ���Ӱ�죬���ҵ�ѹǿ�ϸ�
���𰸡�B
��������A������Ӧ���Ũ��˲�䣬�������������淴Ӧ���ʲ��䣬֮��������
B������ѹǿ�����淴Ӧ���ʶ�����ƽ�ⷢ���ƶ���������������淴Ӧ���ʶ�����������ȣ�ƽ�ⲻ�ƶ���
C�����������ƽ�ⲻ�����ƶ���
D������ѹǿ����Ӧ��������ƽ�������ƶ���
�⣺A������Ӧ���Ũ��˲�䣬�������������淴Ӧ���ʲ��䣬֮��������ͼ��Ӧ������ѹǿ��ԭ��A����
B��ͼ����t0ʱ�����淴Ӧ���ʶ���������ȣ�ƽ�ⲻ�����ƶ���Ӧ�Ǽ��������ԭ��B��ȷ��
C��ͼIII�ס�������ƽ��״̬��ͬ�������������ƽ�ⲻ�����ƶ�����C����
D������ѹǿ����Ӧ��������ƽ�������ƶ���SO2��ת��������D����
��ѡB��
�����㾫�����������⣬������Ҫ�˽⻯ѧƽ��״̬���ʼ�����(��ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч��)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ���������ȷ�Ӧͬʱ����������ԭ��Ӧ������ ��
A. ���ȵ�̿��CO2��Ӧ B. ����ϡ����
C. Ba(OH)2��8H2O��NH4Cl��Ӧ D. Na2O2��H2O�ķ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʵ��γ���������������ĺ����塢�߶�����������嶼�йأ��� ��
A. Ѫ�쵰�� B. ��������ø C. θ����ø D. �Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���ϡ������ij������Ӧ��ʵ������:
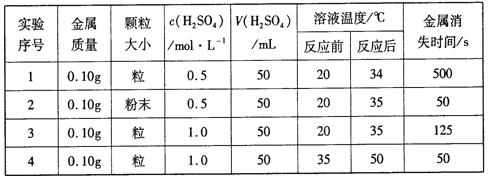
�����������ݣ��ش���������:
��1��ʵ��1��2����,_____�Է�Ӧ������Ӱ��;ʵ��1��3������______�Է�Ӧ������Ӱ�졣
��2��������,����ȫ��ͬ��пƬ�ֱ�Ͷ��100mL0.1mol/L��ϡ�����100mL0.2mol/L��ϡ������,��ϸ�۲���֣����߷�Ӧ���������Բ���:Ͷ�뵽ϡ�����е�п�������������û��Ͷ�뵽ϡ�����еĿ������������۴����Ϊ������һ�����ԭ�������ֿ���:
a�������ӶԷ�Ӧ���˴ٽ����ã��������Ӽӿ��˷�Ӧ�Ľ�����
b��____(��Ĺ۵�)��
Ҫ֤����Ĺ۵�,���������������ֱ�ȡ100mL0.1mol/L��������Һ��������ͬ���ձ��У�һ���ձ��м�һ������____����(�������Լ���ѧʽ),��һ���ձ����Ա�ʵ�����ٷֱ�ͬʱ������ȫ��ͬ��пƬ,�Ƚ����ձ��з�Ӧ���ʵĴ�С��
��3������п����ϡ���ᷴӦ��ȡ����ʱ��������������CuSO4��ĩ���ɼӿ����H2����������ԭ����_________(�����ֱ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ��ͬѹ�£�ͬ�����H2��CH4���ʵ���֮��Ϊ____��ԭ������֮��Ϊ_____������֮��Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����жԷǽ���Ԫ��(��ϡ������Ԫ����)������ж���ȷ����( )
��������������4��Ԫ�ؾ�Ϊ�ǽ���Ԫ��
�ڵ����ڷ�Ӧ�ж�ֻ����������
�۷ǽ���Ԫ�ض�������Ԫ��
�������ﳣ���¶�������ˮ��Ӧ������
�ݢ�A��Ԫ����ͬ�����зǽ�������ǿ��Ԫ��
A.�ڢ�B.�ۢ�C.�ڢۢ�D.�٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���M �п������ã���ϳ�·������ͼ��ʾ:
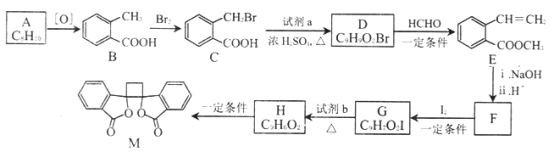
��֪:
��RCH2Br R-HC=CH-R
R-HC=CH-R
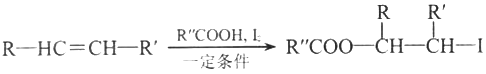
��
��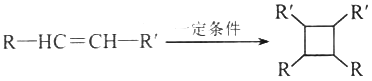
(����R��R'��R�������⡢�������)
��1��A�Ľṹ��ʽ��___________��
��2��B ��������__________��M �еĹ�����������__________ ��
��3���ֱ�д��B-C��G-H �ķ�Ӧ����__________ ��__________ ��
��4��д��C-D �Ļ�ѧ����ʽ__________________��
��5��E ��ͬ���칹���У��������������Ľṹ����_______�֡�
�����Ķ�Ԫȡ���� ����E ������ͬ�Ĺ����� ���ܷ���������Ӧ��ˮ�ⷴӦ
��6����F ��I��һ�������·�Ӧ����G �Ļ�ѧ����ʽ��__________���˷�Ӧͬʱ��������һ���л�����������F��Ϊͬ���칹�壬���л�������Ľṹ��ʽ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����( )
A.ֻ�л�ѧ���γɵı仯��һ���ǻ�ѧ�仯
B.�����ֲ�ͬ�ĺ��ؾ�����ͬ���������������һ��������ͬ��Ԫ��
C.������Ԫ��ԭ�ӵ�������������ͬ������Ԫ�ص�������۲�һ����ͬ
D.�(Li)���������о���ȼ�գ�������Li2O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ���ñ�0.1400molL��1NaOH��Һ�ζ�δ֪Ũ�������ʵ��������� A������ʽ�ζ���ȡϡH2SO4 25.00mL��ע����ƿ�У������̪��
B���ô��ⶨ����Һ��ϴ��ʽ�ζ���
C��������ˮϴ�ɾ��ζ���
D��ȡ�¼�ʽ�ζ����ñ���NaOH��Һ��ϴ����Һע���ʽ�ζ��̶ܿȡ�0������2��3cm�����ٰѼ�ʽ�ζ��̶ܹ��ã�����Һ�����̶ȡ�0����0���̶�����
E�����ζ����Ƿ�©ˮ
F����ȡ��ƿ�����ظ�����һ��
G������ƿ���ڵζ������棬ƿ�µ�һ�Ű�ֽ���ߵα�ҡ����ƿֱ���ζ��յ㣬���µζ���Һ�����ڿ̶ȣ���ȥNaOH��Һ15.00mL��
��1���ٵζ���������ȷ˳���ǣ��������д��������G���������ȷ���յ㣿 ��
��2����ʽ�ζ���������ˮ��ϴ��δ�ñ�Һ��ϴ���µζ�������ƫС������ƫ��ǡ�ú��ʡ��� ��
��3������100mLNaOH����Һ������ʹ�õ��IJ���������
��4���۲��ʽ�ζ��ܶ���ʱ�����ζ�ǰ���ӣ��ζ����ӣ������ᵼ�²�õ�ϡH2SO4��ҺŨ�Ȳⶨֵ��ѡ�ƫ��ƫС������Ӱ�족��
��5���������������Һ�����ʵ���Ũ�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com