
【题目】已知在标准状况下,气体摩尔体积约为22.4L/mol。则在常温常压下(25℃,101kPa)0.2mol气体A的体积为 ( )
A.4.48LB.大于4.48LC.小于4.48LD.无法确定
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】下列关于构成生物体的化学元素和化合物的叙述中,正确的是
A. 蛋白质结构多样性取决于氨基酸的种类、数量、排列顺序和空间结构
B. 青蛙和玉米细胞中的化学元素在种类和含量上基本相同
C. Mg是植物体中各色素分子必不可少的组成元素
D. C、H、O、N是组成生物体的基本元素,其中C是最基本元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | C | N | O | F | Ne | |||
3 | Na | Al | P | S | Cl |
(1)单质的化学性质最不活沷的元素是;
(2)氧的原子结构示意图是;
(3)形成化合物种类最多的元素是;
(4)HF和H2O中,热稳定性较强的是;
(5)N和P中,原子半径较小的是;
(6)常温下,会在浓硫酸中发生钝化的金属是;
(7)元素最高价氧化物对应水化物中,碱性最强的是(填化学式),酸性最强的是(填“H2SO4”或“HClO4”);
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式 , 其中硫元素和氧元素的质量比m(S):m(O)= . (相对原子质量:S﹣32,O﹣16)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用可溶性钡盐检验SO42-离子的存在时,先在待测溶液中加入盐酸,其作用是 ( )
A.形成较多的白色沉淀B.排除SO42-以外的其它阴离子及Ag+的干扰
C.形成的沉淀纯度更高D.排除Ba2+以外的其它阳离子的干扰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是稀硫酸与某金属反应的实验数据:
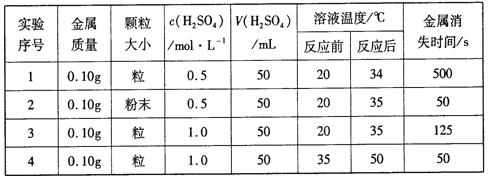
分析上述数据,回答下列问题:
(1)实验1和2表明,_____对反应速率有影响;实验1和3表明,______对反应速率与影响。
(2)室温下,将完全相同的锌片分别投入100mL0.1mol/L的稀硫酸和100mL0.2mol/L的稀盐酸中,仔细观察后发现,两者反应速率有明显差异:投入到稀硫酸中的锌表面产生的气泡没有投入到稀盐酸中的快。经分析讨论大家认为产生这一现象的原因有两种可能:
a、氯离子对反应起了促进作用,即氯离子加快了反应的进行;
b、____(你的观点)。
要证明你的观点,可以在室温下,分别取100mL0.1mol/L的盐酸溶液于两个相同的烧杯中,一个烧杯中加一定量的____固体(填所加试剂化学式),另一个烧杯作对比实验,再分别同时加入完全相同的锌片,比较两烧杯中反应速率的大小。
(3)在用锌粒和稀硫酸反应制取氢气时,往往加人少量CuSO4粉末,可加快产生H2的速率,其原因是_________(用文字表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了改善环境,科学家投入了大量的精力研究碳、氮及其化合物的转化。请回答下列有关问题:
(1)利用N2与H2合成氨是重要的工业反应,下图为反应过程中的能量变化关系。
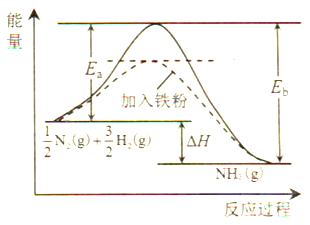
①反应中加入铁粉可以提高反应速率,其原因是____________。
②已知某些化学键键能数据如下表:
化学键 | H-H | N≡N | N-H |
E/(kJ/mol) | 436 | 946 | 391 |
反应![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)的活化能Ea=254kJ/mol,则反应NH3(g)
NH3(g)的活化能Ea=254kJ/mol,则反应NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)的活化能Eb=______kJ/mol。
H2(g)的活化能Eb=______kJ/mol。
(2)汽车内燃机工作时会将N2转化为NO,反应式为N2(g)+O2(g) ![]() 2NO(g),该反应在不同温度下的平衡常数K如下表:
2NO(g),该反应在不同温度下的平衡常数K如下表:
温度 | 27℃ | 2000℃ |
K | 3.8×10-31 | 0.1 |
温度为2000℃,某时刻测得反应体系中各物质的浓度分别为c(N2)=0.2mol/L,c(O2)=0.03mol/L,c(NO)=0.03mol/L,此时该反应的速率(v)应满足的关系为_______(填字母序号)。
A.v正>v逆 B.v正=v逆 C.v正<v逆 D.无法确定
(3)工业上可将CO转化成甲醇,反应式为:CO(g)+2H2(g)![]() CH3OH(g)。若在一容积可变的密闭容器中充入1molCO和2molH2进行反应,初始体积为3L,保持压强不变,反应后CO的平衡转化率随温度(T)的变化如右图中曲线所示。
CH3OH(g)。若在一容积可变的密闭容器中充入1molCO和2molH2进行反应,初始体积为3L,保持压强不变,反应后CO的平衡转化率随温度(T)的变化如右图中曲线所示。

①若所加的CO和H2的量以及反应温度均不变,则达到平衡状态A、B时的压强pA____pB(填“>”、“<”或“=”),其原因是___________________。
②若达到化学平衡状态A时,CO的体积分数为25%,此时CO的转化率为_____;平衡常数KA=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对非金属元素(除稀有气体元素外)的相关判断正确的是( )
①最外层电子数≥4的元素均为非金属元素
②单质在反应中都只能作氧化剂
③非金属元素都是主族元素
④氧化物常温下都可以与水反应生成酸
⑤ⅦA族元素是同周期中非金属性最强的元素
A.②⑤B.③⑤C.②③④D.①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+Br2(l)=2HBr(g) H=-akJ/mol,蒸发1molBr2(l)需要吸收的能量为30kJ,其他数据如下表:
H2(g) | Br2(g) | HBr(g) | |
1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | b | 369 |
下列说法正确的是
A. 2HBr(g)=H2(g)+Br2(g)H=+akJ/mol
B. H2(g)的稳定性低于HBr(g)
C. Br2(g)=Br2(l) H=+30kJ/mol
D. b=272-a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3CH=CH2与HCl可发生反应①和②,其能量与反应进程如下图所示:
① CH3CH=CH2 + HCl → CH3CH2CH2Cl
② CH3CH=CH2 + HCl → CH3CHClCH3
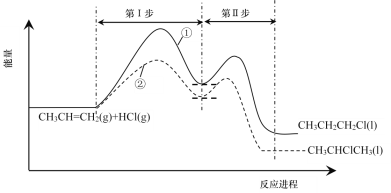
下列说法错误的是
A. 反应①、②均为加成反应
B. 反应①的Ⅰ、Ⅱ两步均放出能量
C. CH3CHClCH3比CH3CH2CH2Cl稳定
D. CH3CH2CH2Cl与CH3CHClCH3互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com