
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:
(1)25℃时,将pH=12的NaOH溶液100mL,要使溶液pH降为11,需加入水的体积为:
(2)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,a与b应满足的关系是 .
【答案】
(1)900mL
(2)a+b=14或pH1+pH2=14
【解析】解:曲线A条件下Kw=c(H+)×c(OH﹣)=10﹣7×10﹣7=10﹣14,曲线B条件下c(H+)=c(OH﹣)=10﹣6 mol/L,Kw=c(H+)c(OH﹣)=10﹣12,水的电离时吸热过程,加热促进电离,所以A代表25℃时水的电离平衡曲线,B为95℃时水的电离曲线,(1)25℃时pH=12NaOH溶液中氢氧根离子的浓度为0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度为0.001mol/L,
稀释过程中氢氧根离子的物质的量基本不变,设需要加入水的体积为x,
则: ![]() =0.001mol/L,解得:x=0.9L=900mL,
=0.001mol/L,解得:x=0.9L=900mL,
所以答案是:900mL;(2)要注意的是95°C时,水的离子积为10﹣12,即酸、碱浓度相等时pH(酸)+pH(碱)=12,现强碱的OH﹣浓度是强酸H+浓度的100倍,所以pH(酸)+pH(碱)=14,即a+b=14或pH1+pH2=14,
所以答案是:a+b=14 或pH1+pH2=14.


科目:高中化学 来源: 题型:
【题目】下表是稀硫酸与某金属反应的实验数据:
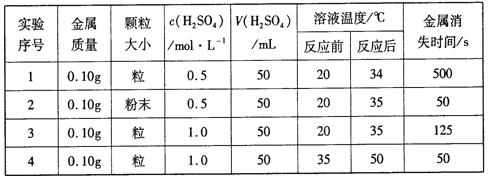
分析上述数据,回答下列问题:
(1)实验1和2表明,_____对反应速率有影响;实验1和3表明,______对反应速率与影响。
(2)室温下,将完全相同的锌片分别投入100mL0.1mol/L的稀硫酸和100mL0.2mol/L的稀盐酸中,仔细观察后发现,两者反应速率有明显差异:投入到稀硫酸中的锌表面产生的气泡没有投入到稀盐酸中的快。经分析讨论大家认为产生这一现象的原因有两种可能:
a、氯离子对反应起了促进作用,即氯离子加快了反应的进行;
b、____(你的观点)。
要证明你的观点,可以在室温下,分别取100mL0.1mol/L的盐酸溶液于两个相同的烧杯中,一个烧杯中加一定量的____固体(填所加试剂化学式),另一个烧杯作对比实验,再分别同时加入完全相同的锌片,比较两烧杯中反应速率的大小。
(3)在用锌粒和稀硫酸反应制取氢气时,往往加人少量CuSO4粉末,可加快产生H2的速率,其原因是_________(用文字表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.只有化学键形成的变化不一定是化学变化
B.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素
C.若两种元素原子的最外层电子数相同,则两元素的最高正价不一定相同
D.锂(Li)能在氧气中剧烈燃烧,产物是Li2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关组成细胞的化学元素说法正确的是
A. 植物细胞中含量最多的四种元素是C、H、O、N
B. 微量元素因含量极少而不如大量元素重要
C. 细胞中某种必需元素可被其他元素替代
D. 组成DNA和RNA的元素种类不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应的说法正确的是( )
A.化学反应常伴随能量的变化
B.反应条件是加热的反应都是吸热反应
C.放热反应都不需要加热就能发生
D.化学反应中的能量变化仅有热量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3CH=CH2与HCl可发生反应①和②,其能量与反应进程如下图所示:
① CH3CH=CH2 + HCl → CH3CH2CH2Cl
② CH3CH=CH2 + HCl → CH3CHClCH3
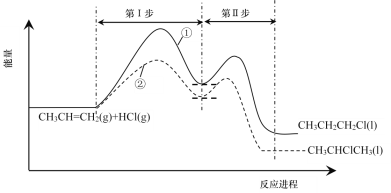
下列说法错误的是
A. 反应①、②均为加成反应
B. 反应①的Ⅰ、Ⅱ两步均放出能量
C. CH3CHClCH3比CH3CH2CH2Cl稳定
D. CH3CH2CH2Cl与CH3CHClCH3互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用标准0.1400molL﹣1NaOH溶液滴定未知浓度硫酸的实验操作如下 A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入酚酞.
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2﹣3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度,用去NaOH溶液15.00mL.
(1)①滴定操作的正确顺序是(用序号填写);②在G操作中如何确定终点? .
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) .
(3)配制100mLNaOH标准溶液,必须使用到的玻璃仪器是
(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值(选填“偏大”“偏小”或“无影响”)
(5)计算待测硫酸溶液的物质的量浓度 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水.已知室温下1g甲硅烷自燃放出44.6kJ, 其热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要从乙酸的乙醇溶液中回收乙酸,合理的操作组合是
①蒸馏 ②过滤 ③静止分液 ④加足量钠 ⑤加入足量H2SO4 ⑥加入足量NaOH溶液 ⑦加入乙酸与浓H2SO4混合液后加热 ⑧加入浓溴水
A.⑦③B.⑧⑤②C.⑥①⑤②D.⑥①⑤①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com