
【题目】设nA代表阿伏伽德罗常数(NA)的数值,下列说法正确的是( )
A.22.4L中含有nA个分子
B.1L0.1mol/LNa2SO4溶液中有0.1个Na+
C.1molH2与1molCl2反应生成nA个HCl分子
D.1molCa变成Ca2+时失去的电子数为2nA
科目:高中化学 来源: 题型:
【题目】在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10﹣10 , 下列说法不正确的是( ) 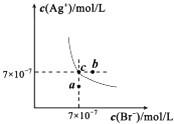
A.在t℃时,AgBr的Ksp为4.9×l0﹣13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t℃时,AgCl(s)+Br﹣(aq)AgBr(s)+Cl﹣(aq)平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞主要化学成分的叙述中,不正确的是 ( )
A. 动物乳汁中的乳糖和植物细胞中的纤维素都属于多糖
B. 胆固醇、维生素D都属于脂质
C. 脱氧核糖核酸是染色体的主要成分之一
D. 蛋白质的多样性与氨基酸的种类、数目和排列顺序等有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:
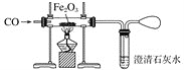
(1)写出得到单质铁的化学方程式:_________________________。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:______。
(3)装置末端气球的作用为_____________________________。实验结束时,应该先停止加热还是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于构成生物体的化学元素和化合物的叙述中,正确的是
A. 蛋白质结构多样性取决于氨基酸的种类、数量、排列顺序和空间结构
B. 青蛙和玉米细胞中的化学元素在种类和含量上基本相同
C. Mg是植物体中各色素分子必不可少的组成元素
D. C、H、O、N是组成生物体的基本元素,其中C是最基本元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下过滤操作中,不正确的是 ( )
A.滤纸应紧贴漏斗内壁并用少量水润湿,使滤纸与漏斗壁之间没有气泡
B.漏斗下端管口应紧靠烧杯内壁
C.倒入漏斗的过滤液的液面应高于滤纸边缘
D.要沿着玻璃棒慢慢向漏斗中倾倒过滤液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是产生和收集气体的实验装置,该装置适合于( ) 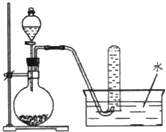
A.用浓硝酸与Cu反应制取NO2
B.用浓盐酸和MnO2反应制取Cl2
C.用H2O2溶液和MnO2反应制取O2
D.用NH4Cl溶液和Ca(OH)2反应制取NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:对于电离常数为Ka的某一元弱酸,pH突变随其浓度的增大而增大,且浓度主要影响滴定终点和滴定终点之后的曲线部分。常温下,用不同浓度的NaOH溶液分别滴定20mL与其同浓度的某弱酸HA溶液,滴定曲线如图所示。下列说法不正确的是
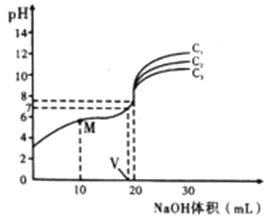
A. 由图可知:c1>c2>c3
B. M点溶液中存在:c(H+)+c(HA)=c(OHˉ)+c(Aˉ)
C. 恰好中和时,溶液中离子浓度的大小关系:c(Na+)>C(Aˉ ) >C(OHˉ )>c(H+)
D. 计算可知HA的电离常数:Ka=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了改善环境,科学家投入了大量的精力研究碳、氮及其化合物的转化。请回答下列有关问题:
(1)利用N2与H2合成氨是重要的工业反应,下图为反应过程中的能量变化关系。
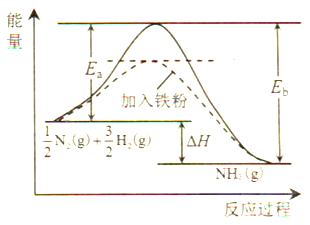
①反应中加入铁粉可以提高反应速率,其原因是____________。
②已知某些化学键键能数据如下表:
化学键 | H-H | N≡N | N-H |
E/(kJ/mol) | 436 | 946 | 391 |
反应![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)的活化能Ea=254kJ/mol,则反应NH3(g)
NH3(g)的活化能Ea=254kJ/mol,则反应NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)的活化能Eb=______kJ/mol。
H2(g)的活化能Eb=______kJ/mol。
(2)汽车内燃机工作时会将N2转化为NO,反应式为N2(g)+O2(g) ![]() 2NO(g),该反应在不同温度下的平衡常数K如下表:
2NO(g),该反应在不同温度下的平衡常数K如下表:
温度 | 27℃ | 2000℃ |
K | 3.8×10-31 | 0.1 |
温度为2000℃,某时刻测得反应体系中各物质的浓度分别为c(N2)=0.2mol/L,c(O2)=0.03mol/L,c(NO)=0.03mol/L,此时该反应的速率(v)应满足的关系为_______(填字母序号)。
A.v正>v逆 B.v正=v逆 C.v正<v逆 D.无法确定
(3)工业上可将CO转化成甲醇,反应式为:CO(g)+2H2(g)![]() CH3OH(g)。若在一容积可变的密闭容器中充入1molCO和2molH2进行反应,初始体积为3L,保持压强不变,反应后CO的平衡转化率随温度(T)的变化如右图中曲线所示。
CH3OH(g)。若在一容积可变的密闭容器中充入1molCO和2molH2进行反应,初始体积为3L,保持压强不变,反应后CO的平衡转化率随温度(T)的变化如右图中曲线所示。

①若所加的CO和H2的量以及反应温度均不变,则达到平衡状态A、B时的压强pA____pB(填“>”、“<”或“=”),其原因是___________________。
②若达到化学平衡状态A时,CO的体积分数为25%,此时CO的转化率为_____;平衡常数KA=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com