
【题目】能用离子方程式“H++OH﹣═H2O”表示的化学反应是( )
A.4HNO3 ![]() 2H2O+4H2O↑+O2↑
2H2O+4H2O↑+O2↑
B.NaOH+HCl═NaCl+H2O
C.CaCO3+2HCl═CaCl2+CO2↑+H2
D.2H2+O2 ![]() 2H2O
2H2O
 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】恒温恒容密闭容器中发生反应2A(g)+B(g)![]() 2C(g),若反应物A的浓度由0.1 mol·L-1降到0.06 mol·L-1需20 s,那么由0.06 mol·L-1降到0.036 mol·L-1所需的时间为( )
2C(g),若反应物A的浓度由0.1 mol·L-1降到0.06 mol·L-1需20 s,那么由0.06 mol·L-1降到0.036 mol·L-1所需的时间为( )
A. 等于10 s B. 等于12 s
C. 大于12 s D. 小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下过滤操作中,不正确的是 ( )
A.滤纸应紧贴漏斗内壁并用少量水润湿,使滤纸与漏斗壁之间没有气泡
B.漏斗下端管口应紧靠烧杯内壁
C.倒入漏斗的过滤液的液面应高于滤纸边缘
D.要沿着玻璃棒慢慢向漏斗中倾倒过滤液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数,下列叙述中正确的是( )
A.12g 12C含中子数为NA
B.标准状况下,22.4L氖气中含有原子数为2NA
C.28g CO和N2混合气体含有的原子数为2NA
D.2mol钠与足量O2完全反应生成Na2O2时失去电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:对于电离常数为Ka的某一元弱酸,pH突变随其浓度的增大而增大,且浓度主要影响滴定终点和滴定终点之后的曲线部分。常温下,用不同浓度的NaOH溶液分别滴定20mL与其同浓度的某弱酸HA溶液,滴定曲线如图所示。下列说法不正确的是
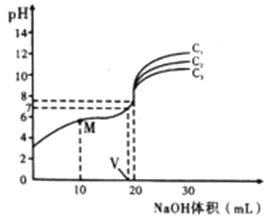
A. 由图可知:c1>c2>c3
B. M点溶液中存在:c(H+)+c(HA)=c(OHˉ)+c(Aˉ)
C. 恰好中和时,溶液中离子浓度的大小关系:c(Na+)>C(Aˉ ) >C(OHˉ )>c(H+)
D. 计算可知HA的电离常数:Ka=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]碳是地球上组成生命的最基本的元素之一。根据要求回答下列问题:
(1)碳原子的价电子排布式______________,核外有_________种不同运动状态的电子。
(2)碳可以形成多种有机化合物,下图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。
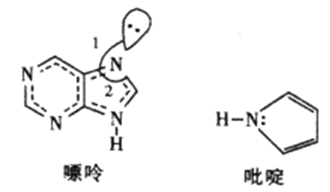
①嘌呤中所有元素的电负性由大到小的顺序__________________。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因__________________。
③吡啶结构中N原子的杂化方式__________________。
④分子中的大π键可用符号π![]() 表示,m代表形成大π键的原子数,n代表参与形成大π键的电子数。则吡啶结构中的大π键表示为__________。
表示,m代表形成大π键的原子数,n代表参与形成大π键的电子数。则吡啶结构中的大π键表示为__________。
(3)碳元素能形成CO、CO2、H2CO3等多种无机化合物。
①二氧化碳的晶体叫做干冰,每个二氧化碳分子周围通常有__________个紧邻的分子。
②在CO转化成CO2的反应过程中,下列说法正确的是__________。
A.分子中孤电子对数不变 B.分子的极性发生变化
C.原子间成键方式发生改变 D.分子晶体的熔沸点升高
③H2CO3与H3PO4均有1个非羟基氧,H3PO4为中强酸,H2CO3为弱酸的原因_________。
(4)2017年,中外科学家团队共同合成了碳的一种新型同素异形体:T-碳。T-碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代形成碳的一种新型三维立方晶体结构,如下图。已知T碳晶胞参数为a pm,阿伏伽德罗常数为NA,则T碳的密度的表达式为__________g/cm3。(写出表达式即可)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用工厂的铁和铜混合屑末,进行如下实验: 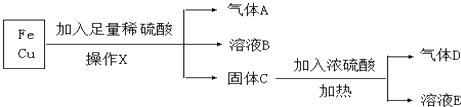
(1)操作X的名称是;
(2)气体D是;
(3)A与氧化铜加热反应生成铜和水,反应中固体的颜色变化是;A作(填“氧化剂”或“还原剂”);
(4)溶液B中的金属阳离子是 , 溶液E中阴离子除了OH﹣外还有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年我国承建全球首艘深海采矿船,具2500米深海作业能力,对未来深海矿产资源的开发具有重要战略价值。海洋深处有丰富的锰结核矿(主要成分为MnO2,含少量Fe、Al等杂质元素),利用锰结核矿可以制备高纯碳酸锰,请回答下列有关问题:
(1)写出用MnO2和浓盐酸制取氯气的化学方程式________________。
(2)MnO2与过氧化氢的反应十分复杂。在酸性条件下,MnO2可以被H2O2还原成Mn2+,但H2O2又有氧化性,有研究表明,H2O2溶液的氧化性是HO2-所致。其他条件相同时,研究不同初始pH条件下H2O2溶液的漂白效果,结果如图所示:
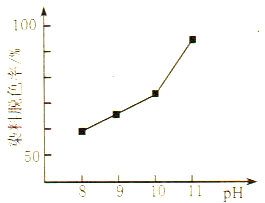
①写出MnO2在酸性条件下与H2O2反应的离子方程式____________。
②由图可得到的结论是_________,结合平衡移动原理简述理由:__________。
(3)利用锰结核矿在实验室制备高纯碳酸锰的流程如下:
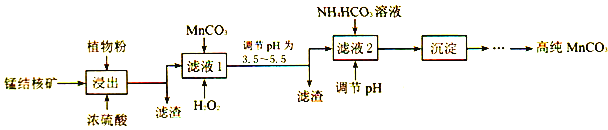
①可用SO2代替植物粉,植物粉的作用是___________。
②使用碳酸锰调pH的优势是___________。
③加入NH4HCO3时,温度要控制在35℃以下,其目的是___________。
(4)在废水处理中常用H2S将Mn2+转化为MnS除去,向含有0.020mo/LMn2+的废水中通入一定量的H2S气体,调节溶液的pH,当c(HS-)=1.0×10-4mol/L时,Mn2+开始沉淀,则此时溶液的pH=______。[已知:Ksp(MnS)=1.4×10-15;H2S的电离常数K1=1.3×10-7,K2=7.0×10-15]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某单位为了营造节日气氛,用铝片和稀硫酸制氢气来填充气球,下列措施不能使该反应速率增大的是( )
A.加入适量NaHSO4固体B.稀硫酸改为浓硫酸
C.加热D.将铝片压薄
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com