
【题目】2017年我国承建全球首艘深海采矿船,具2500米深海作业能力,对未来深海矿产资源的开发具有重要战略价值。海洋深处有丰富的锰结核矿(主要成分为MnO2,含少量Fe、Al等杂质元素),利用锰结核矿可以制备高纯碳酸锰,请回答下列有关问题:
(1)写出用MnO2和浓盐酸制取氯气的化学方程式________________。
(2)MnO2与过氧化氢的反应十分复杂。在酸性条件下,MnO2可以被H2O2还原成Mn2+,但H2O2又有氧化性,有研究表明,H2O2溶液的氧化性是HO2-所致。其他条件相同时,研究不同初始pH条件下H2O2溶液的漂白效果,结果如图所示:
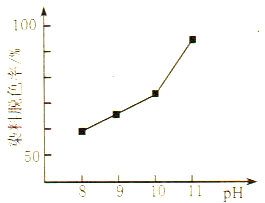
①写出MnO2在酸性条件下与H2O2反应的离子方程式____________。
②由图可得到的结论是_________,结合平衡移动原理简述理由:__________。
(3)利用锰结核矿在实验室制备高纯碳酸锰的流程如下:
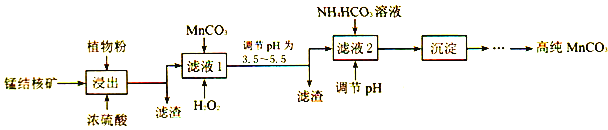
①可用SO2代替植物粉,植物粉的作用是___________。
②使用碳酸锰调pH的优势是___________。
③加入NH4HCO3时,温度要控制在35℃以下,其目的是___________。
(4)在废水处理中常用H2S将Mn2+转化为MnS除去,向含有0.020mo/LMn2+的废水中通入一定量的H2S气体,调节溶液的pH,当c(HS-)=1.0×10-4mol/L时,Mn2+开始沉淀,则此时溶液的pH=______。[已知:Ksp(MnS)=1.4×10-15;H2S的电离常数K1=1.3×10-7,K2=7.0×10-15]
【答案】 MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O MnO2+2H++H2O2=Mn2++2H2O+O2↑ 其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好 pH增大,c(OH-)增大,促使H2O2===HO2-+H+正向移动,c(HO2-)增大,漂白效果越好 作还原剂 不引入新杂质 减少碳酸玺被分解,提高原料利用率 5
【解析】(1)MnO2和浓盐酸加热反应得到氯化锰、氯气和水,化学方程式MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O;正确答案:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O。
(2)①根据题给信息可知MnO2在酸性条件下与H2O2反应,MnO2被还原为锰离子,H2O2被氧化为氧气,反应的离子方程式:MnO2+2H++H2O2=Mn2++2H2O+O2↑;正确答案:MnO2+2H++H2O2=Mn2++2H2O+O2↑。
②根据图像可知:其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好;原因:pH增大,c(OH-)增大,促使H2O2![]() HO2-+H+正向移动,c(HO2-)增大,漂白效果越好;正确答案:其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好;pH增大,c(OH-)增大,促使H2O2
HO2-+H+正向移动,c(HO2-)增大,漂白效果越好;正确答案:其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好;pH增大,c(OH-)增大,促使H2O2![]() HO2-+H+正向移动,c(HO2-)增大,漂白效果越好。
HO2-+H+正向移动,c(HO2-)增大,漂白效果越好。
(3) ①根据流程可知,二氧化锰中+4价锰变为碳酸锰中+2价锰,发生还原反应,植物粉起到还原剂的作用,可用SO2代替植物粉,植物粉的作用是作还原剂,正确答案:作还原剂。
②碳酸锰不溶于水,能够与酸反应,调节溶液的pH,不引入新的杂质;正确答案:不引入新的杂质。
③NH4HCO3在温度较高时,易发生分解,因此在加入NH4HCO3时,温度要控制在35℃以下,减少碳酸氢铵的分解,提高原料利用率;正确答案:减少碳酸氢铵的分解,提高原料利用率。
(4) Mn2+开始沉淀时溶液中硫离子浓度是1.4×1015÷0.020 mol·L1=7.0×1014 mol/L,根据K2=7.0×1015,可知溶液中氢离子浓度是![]() ,所以pH=5;正确答案:5。
,所以pH=5;正确答案:5。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.1molO的质量是16g/molB.Na+的摩尔质量是23g/mol
C.CO2的摩尔质量是44D.H2的摩尔质量就是相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用离子方程式“H++OH﹣═H2O”表示的化学反应是( )
A.4HNO3 ![]() 2H2O+4H2O↑+O2↑
2H2O+4H2O↑+O2↑
B.NaOH+HCl═NaCl+H2O
C.CaCO3+2HCl═CaCl2+CO2↑+H2
D.2H2+O2 ![]() 2H2O
2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯,简称SM,是石化行业的重要基础原料,主要用于生产苯乙烯系列树脂及丁苯橡胶。苯乙烯能发生如下一系列变化。下列说法不正确的是
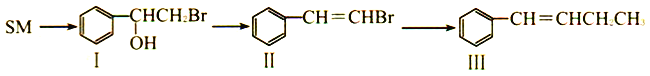
A. 有机物SM能使溴的四氯化碳溶液褪色
B. 有机物I能与金属钠反应放出H2
C. 有机物I、II均能发生氧化反应和加成反应
D. 有机物I的同分异构体中,苯环上只有一个烃基且含有碳碳双键的结构有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在l0L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
4NO(g)+6H2O(g)在l0L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率![]() 可表示为
可表示为
A. ![]() =0.010mol/(L·s) B.
=0.010mol/(L·s) B. ![]() =0.0010 mol/(L·s)
=0.0010 mol/(L·s)
C. ![]() =0.0010 mol/(L·s) D.
=0.0010 mol/(L·s) D. ![]() =0.0045 mol/(L·s)
=0.0045 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2、CO、CH4、CH3OH等都是重要的能源,也是重要为化工原料。
(1)已知25℃,1.01×105Pa时,,8.0DgCH4完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写山该反应的热化学反应方程式:____________________。
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,工业上可以用CO2来生产燃料甲醇。
在体积为2L的密闭容器中,充入lmolCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
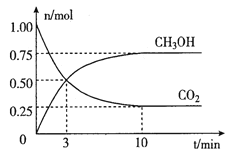
①从反或开始到平衡,CO2的平均反应速率v(CO2)=____。
②达到平衡时,H2的转化率为__________。
③下列措施不能提高反应速率的是__________。
A.升高温度 B.加入催化剂 C.增大压强 D.及时分离出CH3OH
(3)工业上也用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g)![]() CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______。
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1molCO,同时生成1mclCH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五水硫酸铜(CuSO4·5H2O)和六水硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]都是重要的化工原料,用途十分广泛。
请回答与这两种物质中元素有关的一些问题。
(1)基态铁原子的核外电子排布式为_______;基态铜原子的电子占据的最高能层符号为_______ 。
(2)氧元素的第一电离能小于氮元素,其原因是_______ 。
(3)SO42-、H2O、NH4+三种微粒中,空间构型为正四面体的是_______;NH4+中氮原子的杂化轨道类型是_______。
(4)写出与SO42-互为等电子体的分子的化学式_______ (写一种)。
(5)Cu与Au的合金可形成面心立方最密堆积的晶体,在该晶胞中Cu原子处于面心,该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为_______,若该晶体的密度为ρg.cm-3,则晶胞中Cu原子与Au原子中心的最短距离d=_______cm(NA表示阿伏加德罗常数的值)。
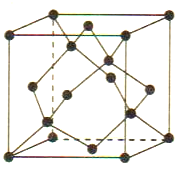
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂和产物已略去):
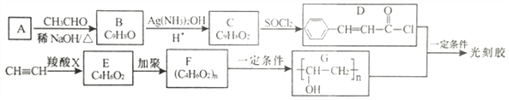
已知:
I. (R1、R2 为烃基或氢原子)
(R1、R2 为烃基或氢原子)
II. ![]() (R1、R2 为烃基或氢原子)
(R1、R2 为烃基或氢原子)
(1)A的化学名称是_________________。C 中官能团的名称是____________________。
(2)C→D 的反应类型是____________,E 的结构简式是_________________________。
(3)D+G→光刻胶的化学方程式为_____________________________。
(4)H是C的同分异构体,具有下列性质或特征:①能发生水解反应和银镜反应;②能使溴水褪色;③属于芳香族化合物,则H 的结构有_____种。其中核磁共振氢谱为5组峰,且峰面积比为1: 1:2:2:2的结构简式为_____________________________。
(5)根据已有知识并结结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2CH2OH的合成路线流程图(无机试剂任用)___________________________________________。合成路线流程图示例如下:
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com