
����Ŀ����̽���һ��Ӧ�ù㷺�Ĺ������ϣ���ϳ�·������(�����Լ��Ͳ�������ȥ):
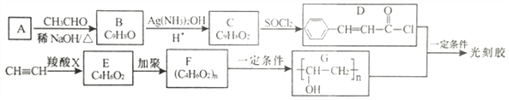
��֪:
I. (R1��R2 Ϊ��������ԭ��)
(R1��R2 Ϊ��������ԭ��)
II. ![]() (R1��R2 Ϊ��������ԭ��)
(R1��R2 Ϊ��������ԭ��)
(1)A�Ļ�ѧ������_________________��C �й����ŵ�������____________________��
(2)C��D �ķ�Ӧ������____________��E �Ľṹ��ʽ��_________________________��
(3)D+G����̽��Ļ�ѧ����ʽΪ_____________________________��
(4)H��C��ͬ���칹�壬�����������ʻ�����:���ܷ���ˮ�ⷴӦ��������Ӧ������ʹ��ˮ��ɫ�������ڷ����廯�����H �Ľṹ��_____�֡����к˴Ź�������Ϊ5��壬�ҷ������Ϊ1: 1:2:2:2�Ľṹ��ʽΪ_____________________________��
(5)��������֪ʶ�����������Ϣ��д����CH3CH2OHΪԭ���Ʊ�CH3CH2CH2CH2OH�ĺϳ�·������ͼ(���Լ�����)___________________________________________���ϳ�·������ͼʾ������:
![]()
���𰸡� ����ȩ �Ȼ���̼̼˫�� ȡ����Ӧ CH3COOCH=CH2 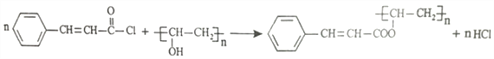 5
5 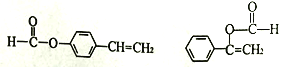 CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO![]() CH3CH=CHCHO
CH3CH=CHCHO![]() CH3CH2CH2 CH2OH
CH3CH2CH2 CH2OH
����������D�Ľṹ��֪��A�к��б�����A��CH3CHO��Ӧ�õ�B�������ʵķ���ʽ����Ϣ����֪AΪ![]() ��BΪ
��BΪ![]() ��B��������Һ����������Ӧ���ữ�õ�C����CΪ
��B��������Һ����������Ӧ���ữ�õ�C����CΪ![]() ����Ȳ������X�ӳ�����E��E�����Ӿ۷�Ӧ�õ�F����E�����к���C=C˫������Ϸ���ʽ��֪��XΪCH3COOH������G�Ľṹ��֪FΪ
����Ȳ������X�ӳ�����E��E�����Ӿ۷�Ӧ�õ�F����E�����к���C=C˫������Ϸ���ʽ��֪��XΪCH3COOH������G�Ľṹ��֪FΪ![]() ����EΪCH3COOCH=CH2��G��D������Ϣ��ķ�Ӧ�õ���̽������̽��Ľṹ��ʽΪ��
����EΪCH3COOCH=CH2��G��D������Ϣ��ķ�Ӧ�õ���̽������̽��Ľṹ��ʽΪ��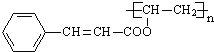 ��
��
(1)ͨ�����Ϸ���֪��A�ṹ��ʽΪ![]() ������Ϊ����ȩ��CΪ
������Ϊ����ȩ��CΪ![]() ��������Ϊ�Ȼ���̼̼˫�����ʴ�Ϊ������ȩ���Ȼ���̼̼˫����
��������Ϊ�Ȼ���̼̼˫�����ʴ�Ϊ������ȩ���Ȼ���̼̼˫����
(3)������������֪��CΪ![]() ����SOCl2����ȡ����Ӧ����
����SOCl2����ȡ����Ӧ����![]() ��E�Ľṹ��ʽΪ��CH3COOCH=CH2���ʴ�Ϊ��ȡ����Ӧ��CH3COOCH=CH2��
��E�Ľṹ��ʽΪ��CH3COOCH=CH2���ʴ�Ϊ��ȡ����Ӧ��CH3COOCH=CH2��
(3)G��D������Ϣ��ķ�Ӧ�õ���̽������̽��Ľṹ��ʽΪ��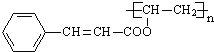 ���÷�Ӧ����ʽΪ��
���÷�Ӧ����ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(4) CΪ![]() ��H��C��ͬ���칹�壬�����������ʻ�����:���ܷ���ˮ�ⷴӦ��˵���ṹ�к����������ܹ�����������Ӧ��˵������ȩ����˵�����ڼ������ࣻ����ʹ��ˮ��ɫ��˵������̼̼˫���������ڷ����廯�����H�Ľṹ�У������Ϻ���2��������һ����CH=CH2��һ��HCOO����3�ֽṹ�������Ϻ���1����������������ΪHCOO��CH=CH����
��H��C��ͬ���칹�壬�����������ʻ�����:���ܷ���ˮ�ⷴӦ��˵���ṹ�к����������ܹ�����������Ӧ��˵������ȩ����˵�����ڼ������ࣻ����ʹ��ˮ��ɫ��˵������̼̼˫���������ڷ����廯�����H�Ľṹ�У������Ϻ���2��������һ����CH=CH2��һ��HCOO����3�ֽṹ�������Ϻ���1����������������ΪHCOO��CH=CH����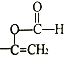 2�ֽṹ����5�֣����к˴Ź�������Ϊ5��壬�ҷ������Ϊ1: 1:2:2:2�Ľṹ��ʽΪ
2�ֽṹ����5�֣����к˴Ź�������Ϊ5��壬�ҷ������Ϊ1: 1:2:2:2�Ľṹ��ʽΪ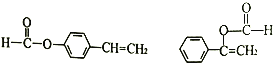 ���ʴ�Ϊ��5��
���ʴ�Ϊ��5��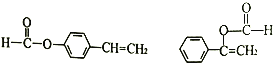 ��
��
(5)��CH3CH2OHΪԭ���Ʊ�CH3CH2CH2CH2OH�������Ҵ�������������ȩ����ȩ�ڼ��������º�ϡNaOH��Һ��Ӧ����CH3CH=CHCHO��CH3CH=CHCHO�������ӳɼ��ɣ��ϳ�·��ΪCH3CH2OH![]() CH3CHO
CH3CHO![]() CH3CH=CHCHO
CH3CH=CHCHO![]() CH3CH2CH2 CH2OH���ʴ�Ϊ��CH3CH2OH
CH3CH2CH2 CH2OH���ʴ�Ϊ��CH3CH2OH![]() CH3CHO
CH3CHO![]() CH3CH=CHCHO
CH3CH=CHCHO![]() CH3CH2CH2 CH2OH��
CH3CH2CH2 CH2OH��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2017���ҹ��н�ȫ��������ɿ���2500�����ҵ��������δ��������Դ�Ŀ���������Ҫս�Լ�ֵ��������зḻ���̽�˿�(��Ҫ�ɷ�ΪMnO2��������Fe��Al������Ԫ��)�������̽�˿�����Ʊ��ߴ�̼���̣���ش������й�����:
��1��д����MnO2��Ũ������ȡ�����Ļ�ѧ����ʽ________________��
��2��MnO2���������ķ�Ӧʮ�ָ��ӡ������������£�MnO2���Ա�H2O2��ԭ��Mn2+����H2O2���������ԣ����о�������H2O2��Һ����������HO2-���¡�����������ͬʱ���о���ͬ��ʼpH������H2O2��Һ��Ư��Ч���������ͼ��ʾ:
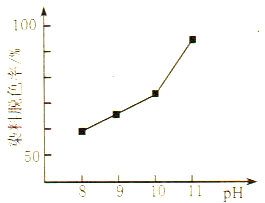
��д��MnO2��������������H2O2��Ӧ�����ӷ���ʽ____________��
����ͼ�ɵõ��Ľ�����_________�����ƽ���ƶ�ԭ����������:__________��
��3�������̽�˿���ʵ�����Ʊ��ߴ�̼���̵��������£�
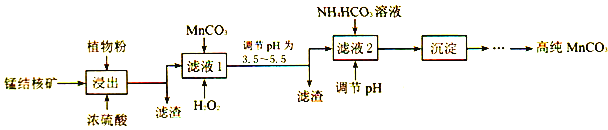
������SO2����ֲ��ۣ�ֲ��۵�������___________��
��ʹ��̼���̵�pH��������___________��
������NH4HCO3ʱ���¶�Ҫ������35�����£���Ŀ����___________��
��4���ڷ�ˮ�����г���H2S��Mn2+ת��ΪMnS��ȥ������0.020mo/LMn2+�ķ�ˮ��ͨ��һ������H2S���壬������Һ��pH����c(HS-)=1.0��10-4mol/Lʱ��Mn2+��ʼ���������ʱ��Һ��pH=______��[��֪:Ksp(MnS)=1.4��10-15��H2S�ĵ��볣��K1=1.3��10-7��K2=7.0��10-15]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��λΪ��Ӫ��������գ�����Ƭ��ϡ����������������������д�ʩ����ʹ�÷�Ӧ�����������( )
A.��������NaHSO4����B.ϡ�����ΪŨ����
C.����D.����Ƭѹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯��������ʡ�
(1)��ҵ�Ͽ�����CO��CO2���Ʊ����Һ��ȼ�ϼ״�����֪: 800��ʱ
��Ӧ��:2H2(g)+CO(g)![]() CH3OH(g) ��H=-90.8 kJ/mol
CH3OH(g) ��H=-90.8 kJ/mol
��Ӧ��:H2(g)+CO2(g)![]() H2O(g)+CO(g) ��H=+41.2kJ/mol
H2O(g)+CO(g) ��H=+41.2kJ/mol
(1)д����CO2��H2��Ӧ�Ʊ��״����Ȼ�ѧ����ʽ___________________________________��
(2)���ڷ�Ӧ�٣������һ�����ܱ������а����ʵ���֮��1:2����CO��H2�����ƽ��������CH3OH����������ڲ�ͬѹǿ�����¶ȵı仯��ͼ1��ʾ���ݴ��ж�
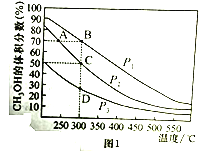
��ѹǿP1_____P2(�>����<����=������ͬ)
��ƽ�ⳣ��K(״̬C)_____K(״̬D)
�۷�Ӧ����:V��(״̬A)_____V��(״̬B)
(3)���ڷ�Ӧ�ڣ������һ�����ܱ������м���һ������H2��CO�����з�Ӧ������˵����ȷ����______��
A.���÷�Ӧ�ں��ݣ����ȵ������н��У���������ѹǿ���ֲ���ʱ������Ӧ�ﵽƽ��״̬
B.�÷�Ӧ�ﵽƽ��ʱ����ƽ����ϵ�г���һ�����ĺ�����ƽ����ܷ����ƶ�
C.���º��������£����ı䷴Ӧ���Ͷ��������H��ֵ�������仯
D.���º��������£���Ͷ��������������ֲ��䣬����ʼͶ�ϱ�[n(H2)/n(CO2)]=X����X=2��1/2ʱ��H2O������������䡣
(4)���ù��ܺ�������ɽ�CO2��H2O(g)ת��ΪCH4��O2������������ʱ���ڲ�ͬ����(I��II��III)�����£�CH4���������ʱ��ı仯����ͼ2��ʾ����0-15h�ڣ��Է�Ӧ��Ч����õĴ�����____________(�����)��
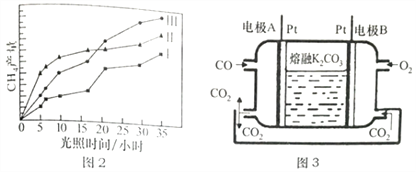
(5)һ������COȼ�ϵ�ع���ԭ������ͼ3��ʾ���õ�ظ����缫��ӦʽΪ______________���缫A��������CO2�в��ֲ���ѭ�����ã���������Ϊ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Se)����(Te)ΪVIA��Ԫ�أ��ǵ�����¼����²��ϵ���Ҫ�ɷ�֮һ����⾫��ͭ����������Ҫ�ɷ�ΪCu2Te��Ag2Se�������������ʼ������������ҵ�ϴ����л����ڡ�����һ�ֹ�����������:

��֪:
I.Se ����������ˮ��TeO2����ˮ�������ڽ�Ũ��ǿ���ǿ�
II.Ԫ��������Һ����Ҫ��Te4+��TeO32-��HTeO3-����ʽ���ڣ�
III.25��ʱ��������(H2TeO3)��Ka1=1��10-3��Ka2=2��10-8��
(1)Se���⻯��ĵ���ʽ��_______________��0.1mol/L��H2TeO3�����(�������������Һ��ﵽ����ƽ��ʱ����Һ���Ѿ�����ĵ���ʷ�����ռԭ���ܷ������İٷ������������) ԼΪ_____________________��
(2) ����Ũ���ᱺ��ǰ�����������д������ȷ��飬��Ŀ����_______________________��
(3) SeO2 ��SO2����ȴ��ͨ��ˮ�з�Ӧ�Ļ�ѧ����ʽ_________________________________����Ӧ������Se���ʵIJ�����Ϊ_________________(���������)��
(4)��ɰ������TeO2��ʽ���ڣ�������NaOH��Һ��Ӧ��õ�����Һ�٣������ʵ���Ҫ�ɷ�Ϊ_______(�ѧʽ��������NaOH����)����ҵ��Ҳ����ͨ�������Һ�ٵõ������ڡ���֪���ʱ�ĵ缫��Ϊʯī���������ĵ缫��ӦʽΪ__________________________________��
(5)����Һ���м�������ʱ������Һ��pH Ϊ4.5~5.0������TeO2���������H2SO4�������������ڵĻ�����__________(�ƫ�ߡ�����ƫ�͡�����Ӱ�족)��
(6)��������TeO2����������õ����Ȼ��ڣ�Ȼ���ٽ�SO2ͨ�뵽��Һ�еõ�Te���ʣ���д�������Ȼ��ڵõ�Te���ʵ����ӷ���ʽ________________________________��
(7)���������п�ѭ�����õ�����_______________(�ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����������Լ������б����ô��������Լ�ƿ����ģ� ��
��NaOH��Һ����ˮ��������Na2S��Һ ��Na2CO3��Һ����NH4Cl��Һ������ʯ��ˮ ��ŨHNO3����ŨH2SO4
A. �٢� B. �٢ڢۢܢ� C. �٢ڢۢޢߢ� D. �ݢߢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��Dz�ͬ�¶���ˮ�����ӻ����ݣ�
�¶�/�� | 25 | t1 | t2 |
ˮ�����ӻ����� | 1��10��14 | �� | 1��10��12 |
�Իش��������⣺
��1����25��t1��t2 �� ���1��10��14���������������=�������������жϵ������� ��
��2��25���£�ijNa2SO4��Һ��c��SO42����=5��10��4 molL��1 �� ȡ����Һ1mL����ˮϡ����10mL����ϡ�ͺ���Һ��c ��Na+����c ��OH����= ��
��3��t2���£���pH=11�Ŀ�������ҺV1 L��pH=1��ϡ����V2 L��ϣ����Ϻ���Һ�����Ϊԭ����Һ���֮�ͣ������û����Һ��pH=2����V1��V2= �� ����Һ�и������ӵ�Ũ���ɴ�С������˳���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�¶���CH3COOH��NH3H2O�ĵ��볣����ȣ�����10mLŨ��Ϊ0.1molL��1��CH3COOH��Һ�еμ���ͬŨ�ȵİ�ˮ���ڵμӹ����У�������
A.ˮ�ĵ���̶�ʼ������
B.![]() �������ټ�С
�������ټ�С
C.c��CH3COOH����c��CH3COO����֮��ʼ�ձ��ֲ���
D.�����백ˮ�����Ϊ10mLʱ��c��NH4+��=c��CH3COO����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com