
【题目】硒(Se)、碲(Te)为VIA族元素,是当今高新技术新材料的主要成分之一,电解精炼铜的阳极泥主要成分为Cu2Te、Ag2Se和少量金属单质及其他化合物,工业上从其中回收碲、硒的一种工艺流程如下:

已知:
I.Se 单质难溶于水。TeO2微溶于水,易溶于较浓的强酸和强碱;
II.元素碲在溶液中主要以Te4+、TeO32-、HTeO3-等形式存在;
III.25℃时,亚碲酸(H2TeO3)的Ka1=1×10-3,Ka2=2×10-8。
(1)Se的氢化物的电子式是_______________。0.1mol/L的H2TeO3电离度(当弱电解质在溶液里达到电离平衡时,溶液中已经电离的电解质分子数占原来总分子数的百分数叫做电离度) 约为_____________________。
(2) 加入浓硫酸焙烧前常将阳极泥中大块颗粒先粉碎,其目的是_______________________。
(3) SeO2 与SO2在冷却后通入水中反应的化学方程式_________________________________。反应后分离出Se单质的操作①为_________________(填操作名称)。
(4)焙砂中碲以TeO2形式存在,与足量NaOH溶液反应后得到的溶液①,其溶质的主要成分为_______(填化学式,过量的NaOH除外)。工业上也可以通过电解溶液①得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为__________________________________。
(5)向溶液①中加入硫酸时控制溶液的pH 为4.5~5.0,生成TeO2沉淀,如果H2SO4过量,将导致碲的回收率__________(填“偏高”、“偏低”或“无影响”)。
(6)将纯净的TeO2先溶于盐酸得到四氯化碲,然后再将SO2通入到溶液中得到Te单质,请写出由四氯化碲得到Te单质的离子方程式________________________________。
(7)上述流程中可循环利用的物质_______________(填化学式)。
【答案】 ![]() 10% 增大接触面积,提高反应速率 SeO2+2SO2+2H2O=2H2SO4+Se↓ 过滤 Na2TeO3 TeO32-+3H2O+4e-=Te+6OH- 偏低 Te4++2SO2+4H2O=Te+8H++2SO42- H2SO4、HCl
10% 增大接触面积,提高反应速率 SeO2+2SO2+2H2O=2H2SO4+Se↓ 过滤 Na2TeO3 TeO32-+3H2O+4e-=Te+6OH- 偏低 Te4++2SO2+4H2O=Te+8H++2SO42- H2SO4、HCl
【解析】(1)Se与O属于同族元素,氢化物的电子式为![]() 。设电离的亚碲酸为xmol/L,(H2TeO3)的Ka1=1×10-3=
。设电离的亚碲酸为xmol/L,(H2TeO3)的Ka1=1×10-3=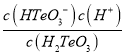 =
=![]() ,解得x=0.01,则0.1mol/L的H2TeO3电离度=
,解得x=0.01,则0.1mol/L的H2TeO3电离度=![]() ×100%=10%,故答案为:
×100%=10%,故答案为:![]() ;10%;
;10%;
(2)加入浓硫酸焙烧前常将阳极泥中大块颗粒先粉碎,可以增大接触面积,提高反应速率,故答案为:增大接触面积,提高反应速率;
(3)根据流程图,SeO2与SO2在冷却后通入水中反应生成Se,反应的化学方程式为SeO2+2SO2+2H2O=2H2SO4+Se↓。Se单质难溶于水,反应后分离出Se单质可以通过过滤分离,故答案为:SeO2+2SO2+2H2O=2H2SO4+Se↓;过滤;
(4) TeO2微溶于水,易溶于较浓的强酸和强碱。焙砂中碲以TeO2形式存在,与足量NaOH溶液反应后得到的溶液①,其溶质的主要成分为Na2TeO3。工业上也可以通过电解溶液①得到单质碲,电解时的电极均为石墨,则阴极发生还原反应,TeO32-得到电子生成Te,电极反应式为TeO32-+3H2O+4e-=Te+6OH-,故答案为:Na2TeO3;TeO32-+3H2O+4e-=Te+6OH-;
(5) TeO2微溶于水,易溶于较浓的强酸和强碱。向溶液①中加入硫酸时控制溶液的pH为4.5~5.0,生成TeO2沉淀,如果H2SO4过量,将导致生成的TeO2沉淀偏少,碲的回收率偏低,故答案为:偏低;
(6)将纯净的TeO2先溶于盐酸得到四氯化碲,然后再将SO2通入到溶液中得到Te单质,二氧化硫被氧化生成硫酸,反应的离子方程式为Te4++2SO2+4H2O=Te+8H++2SO42-,故答案为:Te4++2SO2+4H2O=Te+8H++2SO42-;
(7)根据流程图和上述(6)的方程式可知,Te4++2SO2+4H2O=Te+8H++2SO42-反应中生成的盐酸和硫酸可以循环利用,故答案为:H2SO4、HCl。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在l0L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
4NO(g)+6H2O(g)在l0L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率![]() 可表示为
可表示为
A. ![]() =0.010mol/(L·s) B.
=0.010mol/(L·s) B. ![]() =0.0010 mol/(L·s)
=0.0010 mol/(L·s)
C. ![]() =0.0010 mol/(L·s) D.
=0.0010 mol/(L·s) D. ![]() =0.0045 mol/(L·s)
=0.0045 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关甲烷的叙述正确的是( )
A.甲烷不能使高锰酸钾酸性溶液褪色,所以甲烷不能发生氧化反应
B.甲烷与氯气的取代反应,生成的产物中CH3Cl最多
C.CH4的键角均为10928,可以说明甲烷分子是以碳原子为中心的正四面体结构,而不是平面正方形结构
D.甲烷、乙烷、丙烷是同系物,它们中的化学键都是极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下含碳各微粒H2CO3、HCO3﹣和CO32﹣存在于CO2和NaOH溶液反应后的溶液中,它们的物质的量分数与溶液pH的关系如图所示,下列说法错误的是( ) 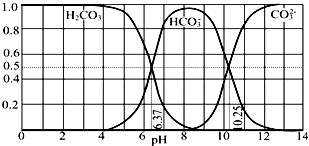
A.pH=10.25时,c(Na+)═c(CO32﹣)+c(HCO3﹣)
B.为获得尽可能纯的NaHCO3 , 宜控制溶液的pH为7~9之间
C.根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10﹣6.37
D.若是0.1mol NaOH 反应后所得的1L溶液,pH=10时,溶液中存在以下关系:c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Cl2通入水中:Cl2+H2O = 2H++Cl-+ClO-
B. AlCl3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
C. H2SO4加入Ba(OH)2溶液中:Ba2++SO42-=BaSO4↓
D. 盐酸酸化的H2O2加入FeSO4溶液中:Fe2++H2O2+2H+= Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂和产物已略去):
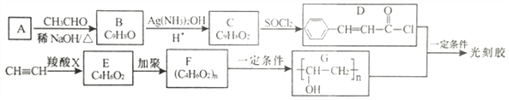
已知:
I. (R1、R2 为烃基或氢原子)
(R1、R2 为烃基或氢原子)
II. ![]() (R1、R2 为烃基或氢原子)
(R1、R2 为烃基或氢原子)
(1)A的化学名称是_________________。C 中官能团的名称是____________________。
(2)C→D 的反应类型是____________,E 的结构简式是_________________________。
(3)D+G→光刻胶的化学方程式为_____________________________。
(4)H是C的同分异构体,具有下列性质或特征:①能发生水解反应和银镜反应;②能使溴水褪色;③属于芳香族化合物,则H 的结构有_____种。其中核磁共振氢谱为5组峰,且峰面积比为1: 1:2:2:2的结构简式为_____________________________。
(5)根据已有知识并结结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2CH2OH的合成路线流程图(无机试剂任用)___________________________________________。合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取少量某镁铝合金粉末,其组成可用MgxAly表示,向其中加入足量稀硫酸充分反应,收集到3.808L H2(标准状况)同时得无色溶液,向所得溶液中加入过量NaOH溶液,充分反应得到沉淀4.64g。则x∶y为
A. 2∶1 B. 4∶3 C. 1∶1 D. 1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有H、N、O、Na、Cl、Fe、Cu七种常见元素,回答下列问题:
(1)Cl位于周期表第____周期____族。
(2)Na+离子的结构示意图为____。
(3)能说明非金属性Cl比N强的事实是____(用方程式表示)。
(4)A~L是由上述七种元素中的一种、二种或三种组成,A的摩尔质量为166g·mol-1,其焰色反应呈黄色;B是最常见的液体;C中两元素的质量比为96∶7; D、E属同类物质,E呈红褐色。F、G、H、I为单质,其中F、G是无色气体,H是紫红色固体,I是黄绿色气体;L是常见的强酸。它们有如下图所示的关系(部分反应条件及产物已略去):
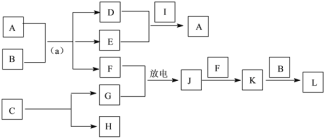
①C的化学式为____。
②D的电子式为____。
③L的稀溶液与H反应的离子方程式为____。
④反应(a)的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E、F的原子序数依次增大,A和B形成的气态化合物的水溶液呈碱性,A和D同主族,B和C相邻,F的最高价氧化物对应的水化物为无机含氧酸中的最强酸。E与B可构成化合物E3B2,且该物质遇水发生水解反应。已知利用如下装置以制备E3B2,装置①用于制备B单质。下列说法错误的是( )
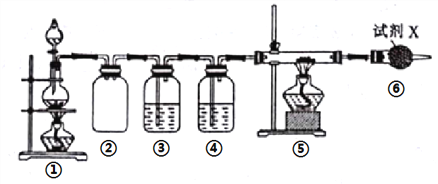
A. E与B的简单离子的电子层结构相同,且离子半径B>E
B. ③、④、⑥中依次盛装的试剂可以是NaOH溶液浓H2SO4、碱石灰
C. A、B、C三种元素组成的化合物可能与F的最高价氧化物对应的水化物反应
D. 实验结束,取⑤中的少量产物于试管中,加适量蒸馏水,可以使试管口湿润的红色石蕊试纸变蓝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com