
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在l0L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
4NO(g)+6H2O(g)在l0L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率![]() 可表示为
可表示为
A. ![]() =0.010mol/(L·s) B.
=0.010mol/(L·s) B. ![]() =0.0010 mol/(L·s)
=0.0010 mol/(L·s)
C. ![]() =0.0010 mol/(L·s) D.
=0.0010 mol/(L·s) D. ![]() =0.0045 mol/(L·s)
=0.0045 mol/(L·s)
【答案】C
【解析】根据V=C/t计算![]() ,再利用速率之比等于化学计量数之比计算各物质表示的反应速率进行判断。
,再利用速率之比等于化学计量数之比计算各物质表示的反应速率进行判断。
在体积l0L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则![]() =0.45/(10×30)=0.0015 mol/(L·s);速率之比等于化学计量数之比,所以
=0.45/(10×30)=0.0015 mol/(L·s);速率之比等于化学计量数之比,所以![]() =2/3×0.0015=0.0010 mol/(L·s),A错误;速率之比等于化学计量数之比,所以
=2/3×0.0015=0.0010 mol/(L·s),A错误;速率之比等于化学计量数之比,所以![]() =5/6×0.0015=0.00125 mol/(L·s),B错误;速率之比等于化学计量数之比,所以
=5/6×0.0015=0.00125 mol/(L·s),B错误;速率之比等于化学计量数之比,所以![]() =2/3×0.0015=0.0010 mol/(L·s),C正确;
=2/3×0.0015=0.0010 mol/(L·s),C正确; ![]() =0.45/(10×30)=0.0015 mol/(L·s), D错误;正确选项C。
=0.45/(10×30)=0.0015 mol/(L·s), D错误;正确选项C。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:
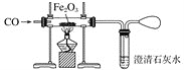
(1)写出得到单质铁的化学方程式:_________________________。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:______。
(3)装置末端气球的作用为_____________________________。实验结束时,应该先停止加热还是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:对于电离常数为Ka的某一元弱酸,pH突变随其浓度的增大而增大,且浓度主要影响滴定终点和滴定终点之后的曲线部分。常温下,用不同浓度的NaOH溶液分别滴定20mL与其同浓度的某弱酸HA溶液,滴定曲线如图所示。下列说法不正确的是
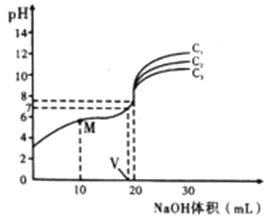
A. 由图可知:c1>c2>c3
B. M点溶液中存在:c(H+)+c(HA)=c(OHˉ)+c(Aˉ)
C. 恰好中和时,溶液中离子浓度的大小关系:c(Na+)>C(Aˉ ) >C(OHˉ )>c(H+)
D. 计算可知HA的电离常数:Ka=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用工厂的铁和铜混合屑末,进行如下实验: 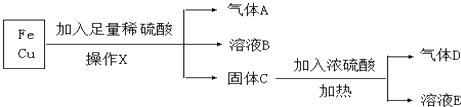
(1)操作X的名称是;
(2)气体D是;
(3)A与氧化铜加热反应生成铜和水,反应中固体的颜色变化是;A作(填“氧化剂”或“还原剂”);
(4)溶液B中的金属阳离子是 , 溶液E中阴离子除了OH﹣外还有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用可溶性钡盐检验SO42-离子的存在时,先在待测溶液中加入盐酸,其作用是 ( )
A.形成较多的白色沉淀B.排除SO42-以外的其它阴离子及Ag+的干扰
C.形成的沉淀纯度更高D.排除Ba2+以外的其它阳离子的干扰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年我国承建全球首艘深海采矿船,具2500米深海作业能力,对未来深海矿产资源的开发具有重要战略价值。海洋深处有丰富的锰结核矿(主要成分为MnO2,含少量Fe、Al等杂质元素),利用锰结核矿可以制备高纯碳酸锰,请回答下列有关问题:
(1)写出用MnO2和浓盐酸制取氯气的化学方程式________________。
(2)MnO2与过氧化氢的反应十分复杂。在酸性条件下,MnO2可以被H2O2还原成Mn2+,但H2O2又有氧化性,有研究表明,H2O2溶液的氧化性是HO2-所致。其他条件相同时,研究不同初始pH条件下H2O2溶液的漂白效果,结果如图所示:
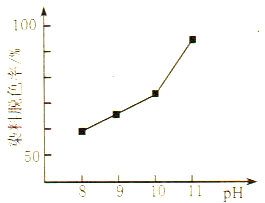
①写出MnO2在酸性条件下与H2O2反应的离子方程式____________。
②由图可得到的结论是_________,结合平衡移动原理简述理由:__________。
(3)利用锰结核矿在实验室制备高纯碳酸锰的流程如下:
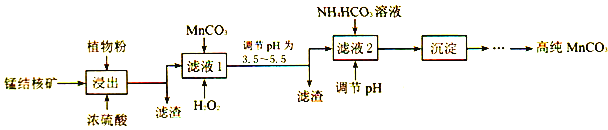
①可用SO2代替植物粉,植物粉的作用是___________。
②使用碳酸锰调pH的优势是___________。
③加入NH4HCO3时,温度要控制在35℃以下,其目的是___________。
(4)在废水处理中常用H2S将Mn2+转化为MnS除去,向含有0.020mo/LMn2+的废水中通入一定量的H2S气体,调节溶液的pH,当c(HS-)=1.0×10-4mol/L时,Mn2+开始沉淀,则此时溶液的pH=______。[已知:Ksp(MnS)=1.4×10-15;H2S的电离常数K1=1.3×10-7,K2=7.0×10-15]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了改善环境,科学家投入了大量的精力研究碳、氮及其化合物的转化。请回答下列有关问题:
(1)利用N2与H2合成氨是重要的工业反应,下图为反应过程中的能量变化关系。
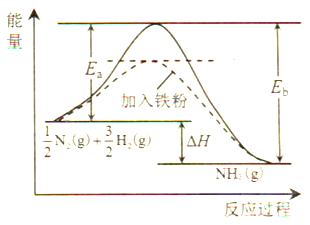
①反应中加入铁粉可以提高反应速率,其原因是____________。
②已知某些化学键键能数据如下表:
化学键 | H-H | N≡N | N-H |
E/(kJ/mol) | 436 | 946 | 391 |
反应![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)的活化能Ea=254kJ/mol,则反应NH3(g)
NH3(g)的活化能Ea=254kJ/mol,则反应NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)的活化能Eb=______kJ/mol。
H2(g)的活化能Eb=______kJ/mol。
(2)汽车内燃机工作时会将N2转化为NO,反应式为N2(g)+O2(g) ![]() 2NO(g),该反应在不同温度下的平衡常数K如下表:
2NO(g),该反应在不同温度下的平衡常数K如下表:
温度 | 27℃ | 2000℃ |
K | 3.8×10-31 | 0.1 |
温度为2000℃,某时刻测得反应体系中各物质的浓度分别为c(N2)=0.2mol/L,c(O2)=0.03mol/L,c(NO)=0.03mol/L,此时该反应的速率(v)应满足的关系为_______(填字母序号)。
A.v正>v逆 B.v正=v逆 C.v正<v逆 D.无法确定
(3)工业上可将CO转化成甲醇,反应式为:CO(g)+2H2(g)![]() CH3OH(g)。若在一容积可变的密闭容器中充入1molCO和2molH2进行反应,初始体积为3L,保持压强不变,反应后CO的平衡转化率随温度(T)的变化如右图中曲线所示。
CH3OH(g)。若在一容积可变的密闭容器中充入1molCO和2molH2进行反应,初始体积为3L,保持压强不变,反应后CO的平衡转化率随温度(T)的变化如右图中曲线所示。

①若所加的CO和H2的量以及反应温度均不变,则达到平衡状态A、B时的压强pA____pB(填“>”、“<”或“=”),其原因是___________________。
②若达到化学平衡状态A时,CO的体积分数为25%,此时CO的转化率为_____;平衡常数KA=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺(CH3NH2)是一种应用广泛的一元弱碱。常温下,向200mL0.10mol/L的甲胺溶液中滴加V mL.0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是
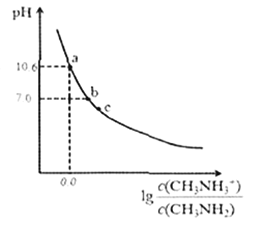
A. b点对应加入盐酸的体积V< 20.00mL
B. 甲胺在水中的电离方程式为:CH3NH2+H2O![]() CH3NH3++OH-
CH3NH3++OH-
C. 常温下,甲胺的电离常数为Kb,则pKb=-1gKb=4.3
D. c点可能存在关系: 2c(H+)+ c(CH3NH3+)=c(CH3NH2) +2c(OH- )+ c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)、碲(Te)为VIA族元素,是当今高新技术新材料的主要成分之一,电解精炼铜的阳极泥主要成分为Cu2Te、Ag2Se和少量金属单质及其他化合物,工业上从其中回收碲、硒的一种工艺流程如下:

已知:
I.Se 单质难溶于水。TeO2微溶于水,易溶于较浓的强酸和强碱;
II.元素碲在溶液中主要以Te4+、TeO32-、HTeO3-等形式存在;
III.25℃时,亚碲酸(H2TeO3)的Ka1=1×10-3,Ka2=2×10-8。
(1)Se的氢化物的电子式是_______________。0.1mol/L的H2TeO3电离度(当弱电解质在溶液里达到电离平衡时,溶液中已经电离的电解质分子数占原来总分子数的百分数叫做电离度) 约为_____________________。
(2) 加入浓硫酸焙烧前常将阳极泥中大块颗粒先粉碎,其目的是_______________________。
(3) SeO2 与SO2在冷却后通入水中反应的化学方程式_________________________________。反应后分离出Se单质的操作①为_________________(填操作名称)。
(4)焙砂中碲以TeO2形式存在,与足量NaOH溶液反应后得到的溶液①,其溶质的主要成分为_______(填化学式,过量的NaOH除外)。工业上也可以通过电解溶液①得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为__________________________________。
(5)向溶液①中加入硫酸时控制溶液的pH 为4.5~5.0,生成TeO2沉淀,如果H2SO4过量,将导致碲的回收率__________(填“偏高”、“偏低”或“无影响”)。
(6)将纯净的TeO2先溶于盐酸得到四氯化碲,然后再将SO2通入到溶液中得到Te单质,请写出由四氯化碲得到Te单质的离子方程式________________________________。
(7)上述流程中可循环利用的物质_______________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com