
【题目】已知某温度下CH3COOH和NH3H2O的电离常数相等,现向10mL浓度为0.1molL﹣1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.![]() 先增大再减小
先增大再减小
C.c(CH3COOH)与c(CH3COO﹣)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO﹣)
【答案】D
【解析】解:A.酸溶液、碱溶液抑制了水的电离,溶液显示中性前,随着氨水的加入,溶液中氢离子浓度逐渐减小,水的电离程度逐渐增大;当氨水过量后,随着溶液中氢氧根离子浓度逐渐增大,水的电离程度逐渐减小,所以滴加过程中,水的电离程度先增大后减小,故A错误;
B.当向CH3COOH溶液中滴加相同浓度的氨水,开始时溶液为CH3COOH和CH3COONH4的混合物,由CH3COONH4的水解常数Kh= ![]() ,随着氨水的加入,c(H+)逐渐减小,Kh不变,则
,随着氨水的加入,c(H+)逐渐减小,Kh不变,则 ![]() 变小,当加氨水至溶液显碱性时,氨水的电离常数Kb=
变小,当加氨水至溶液显碱性时,氨水的电离常数Kb= ![]() ,c(OH﹣)与氢离子浓度成反比,随着氨水的滴入,氢氧根离子浓度逐渐增大,电离常数K不变,所以
,c(OH﹣)与氢离子浓度成反比,随着氨水的滴入,氢氧根离子浓度逐渐增大,电离常数K不变,所以 ![]() 逐渐减小,即
逐渐减小,即 ![]() 始终减小,故B错误;
始终减小,故B错误;
C.n(CH3COOH)与n(CH3COO﹣)之和为0.001mol,始终保持不变,由于溶液体积逐渐增大,所以c(CH3COOH)与c(CH3COO﹣)之和逐渐减小,故C错误;
D.当加入氨水的体积为10mL时,醋酸和一水合氨的物质的量相等,由于二者的电离常数相等,所以溶液显示中性,c(H+)=c(OH﹣),根据电荷守恒可知:c(NH4+)=c(CH3COO﹣),故D正确;
故选D.
A.开始时,溶液的酸性逐渐减弱,水的电离程度逐渐增大,当氨水过量后,溶液中氢氧根离子浓度逐渐增大,水的电离程度逐渐减小;
B.根据一水合氨的电离平衡常数可知,该比值与氢氧根离子成反比,电解氨水的过程中,溶液中氢氧根离子浓度逐渐增大;
C.根据物料守恒,醋酸和醋酸根离子的物质的量之和不变,但是溶液体积增大,二者的浓度之和逐渐减小;
D.CH3COOH和NH3H2O的电离常数相等,氨水与醋酸的浓度、体积相等时,溶液显示中性,根据电荷守恒可知c(NH4+)=c(CH3COO﹣).


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
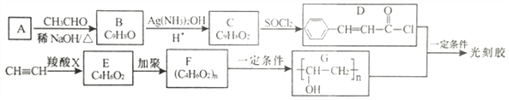
【题目】光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂和产物已略去):
已知:
I. (R1、R2 为烃基或氢原子)
(R1、R2 为烃基或氢原子)
II. ![]() (R1、R2 为烃基或氢原子)
(R1、R2 为烃基或氢原子)
(1)A的化学名称是_________________。C 中官能团的名称是____________________。
(2)C→D 的反应类型是____________,E 的结构简式是_________________________。
(3)D+G→光刻胶的化学方程式为_____________________________。
(4)H是C的同分异构体,具有下列性质或特征:①能发生水解反应和银镜反应;②能使溴水褪色;③属于芳香族化合物,则H 的结构有_____种。其中核磁共振氢谱为5组峰,且峰面积比为1: 1:2:2:2的结构简式为_____________________________。
(5)根据已有知识并结结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2CH2OH的合成路线流程图(无机试剂任用)___________________________________________。合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电动公交车替代燃油公交车是节能减排、控制雾霾的重要举措之一,下图所示电池是一种正在开发的车载电池。有关该电池的说法正确的是
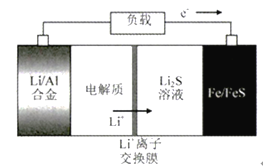
A. 放电时Fe/FeS极是负极
B. 放电时负极反应式为:Al-3e-=Al3+
C. 充电时阳极反应式为:Fe+S2--2e-=FeS
D. 左边电解质可以是LiOH的醇溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有H、N、O、Na、Cl、Fe、Cu七种常见元素,回答下列问题:
(1)Cl位于周期表第____周期____族。
(2)Na+离子的结构示意图为____。
(3)能说明非金属性Cl比N强的事实是____(用方程式表示)。
(4)A~L是由上述七种元素中的一种、二种或三种组成,A的摩尔质量为166g·mol-1,其焰色反应呈黄色;B是最常见的液体;C中两元素的质量比为96∶7; D、E属同类物质,E呈红褐色。F、G、H、I为单质,其中F、G是无色气体,H是紫红色固体,I是黄绿色气体;L是常见的强酸。它们有如下图所示的关系(部分反应条件及产物已略去):
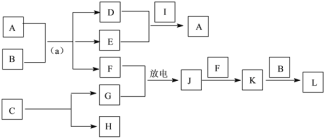
①C的化学式为____。
②D的电子式为____。
③L的稀溶液与H反应的离子方程式为____。
④反应(a)的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜广泛应用于有机合成、石油、油脂、染料等工业。以某种铜矿粉(含Cu2S、CuS及FeS等)为原料制取CuCl的工艺流程如下:
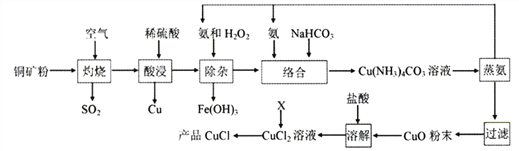
已知:①CuS、Cu2S、FeS灼烧固体产物为Cu2O、FeO;
②Ksp(CuCl)=2×10-7,2Cu+=Cu+Cu2+的平衡常数K1=1×106
回答下列问题:
(1)“灼烧”时,被还原的元素有____________(填元素符号)。
(2)“酸浸”所需H2SO4是用等体积的98%H2SO4和水混合而成。实验室配制该硫酸溶液所需的玻璃仪器除玻璃棒、胶头滴管外,还有_______。“酸浸”时硫酸不宜过多的原因是__________________。
(3)“除杂”的总反应方程式是_____________________。
(4)“络合”反应中的NH3与NaHCO3理论比值是____________________。
(5)加热“蒸氨”在减压条件下进行的原因是________________。
(6)X可以充分利用流程中的产物,若X是SO2时,通入CuCl2溶液中反应的离子方程式是________________;若X是Cu时,反应Cu+Cu2++2Cl-=2CuCl的平衡常数K2=_________。
(7)以铜为阳极电解NaCl溶液也可得到CuCl,写出阳极电极反应式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)羟基的电子式;
(2)相对分子质量为72且沸点最低的烷烃的结构简式;
(3)合成高聚物  其单体的结构简式;
其单体的结构简式;
(4)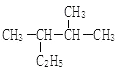 的名称(系统命名法) .
的名称(系统命名法) .
(5)甲烷具有型的空间结构,而乙炔则具有型空间结构.
(6)苯酚遇FeCl3溶液会显色;蛋白质与浓硝酸共热会变色;淀粉遇碘则显色.这些特性常被用于物质的检验或鉴别.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用0.1mol/LHCl滴定10ml 0.05mol/L氢氧化钠溶液,若酸式滴定管未润洗,达到终点时所用盐酸的体积应是( )
A.10mL
B.5mL
C.大于5Ml
D.小于5mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com