
【题目】氯化亚铜广泛应用于有机合成、石油、油脂、染料等工业。以某种铜矿粉(含Cu2S、CuS及FeS等)为原料制取CuCl的工艺流程如下:
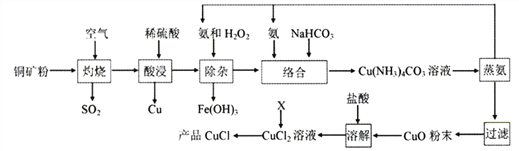
已知:①CuS、Cu2S、FeS灼烧固体产物为Cu2O、FeO;
②Ksp(CuCl)=2×10-7,2Cu+=Cu+Cu2+的平衡常数K1=1×106
回答下列问题:
(1)“灼烧”时,被还原的元素有____________(填元素符号)。
(2)“酸浸”所需H2SO4是用等体积的98%H2SO4和水混合而成。实验室配制该硫酸溶液所需的玻璃仪器除玻璃棒、胶头滴管外,还有_______。“酸浸”时硫酸不宜过多的原因是__________________。
(3)“除杂”的总反应方程式是_____________________。
(4)“络合”反应中的NH3与NaHCO3理论比值是____________________。
(5)加热“蒸氨”在减压条件下进行的原因是________________。
(6)X可以充分利用流程中的产物,若X是SO2时,通入CuCl2溶液中反应的离子方程式是________________;若X是Cu时,反应Cu+Cu2++2Cl-=2CuCl的平衡常数K2=_________。
(7)以铜为阳极电解NaCl溶液也可得到CuCl,写出阳极电极反应式__________________。
【答案】 Cu 和O 量筒、烧杯 避免除杂时消耗过多的氨水 2Fe2++H2O2+4NH3·H2O(或 4NH3+4H2O)=2Fe(OH)3↓+4NH4+ 5:1 减压能降低气体的溶解度,有利于气体逸出 2Cu2++2Cl-+SO2+2H2O= SO42-+2CuCl↓+ 4H+ 2.5×107L3/moL3 Cu+Cl—e-=CuCl
【解析】(1)从流程过程看出,铜矿粉在空气中灼烧后生成二氧化硫气体和铜,硫元素被氧化,铜元素和氧元素被还原;正确答案:Cu 和O。
(2)配制酸浸所用的硫酸,由于98%H2SO4和水为等体积混合,因此分别用量筒量一定体积水放入烧杯中,再用量筒量取相同体积的98%H2SO4转移到烧杯中,混合搅拌;酸浸”时硫酸是用来溶解氧化铁,但是酸剩余的太多,后面反应中还要加入过多的氨水来中和硫酸;正确答案:量筒、烧杯;避免除杂时消耗过多的氨水。
(3)溶液中亚铁离子被过氧化氢氧化为铁离子,铁离子与氨水反应生成氢氧化铁沉淀;除杂”的总反应方程式是2Fe2++H2O2+4NH3·H2O(或 4NH3+4H2O)=2Fe(OH)3↓+4NH4+ ;正确答案: 2Fe2++H2O2+4NH3·H2O(或 4NH3+4H2O)=2Fe(OH)3↓+4NH4+。
(4)根据流程可知“络合”反应Cu2++HCO3-+5NH3= Cu(NH3)4CO3+NH4+,NH3与NaHCO3理论比值是5:1;正确答案:5:1。
(5)Cu(NH3)4CO3加热分解产生氨气,氨气易溶于水,因此减压能降低气体的溶解度,有利于气体逸出 ;正确答案:减压能降低气体的溶解度,有利于气体逸出。
(6)SO2具有还原性,能够被铜离子氧化为硫酸根离子,本身还原为亚铜l离子,与氯离子结合生成CuCl沉淀,离子方程式为2Cu2++2Cl-+SO2+2H2O= SO42-+2CuCl↓+ 4H+ ;根据2Cu+=Cu+Cu2+的平衡常数K1=1×106可知:c(Cu)×c(Cu2+)/c2(Cu+)=1×106,c(Cu)×c(Cu2+)=106×c2(Cu+);2CuCl=Cu+Cu2++2Cl-,K=c(Cu)×c(Cu2+)×c2(Cl-)=106 c2(Cu+)×c2(Cl-)=106×Ksp2(CuCl)= 106×(2×10-7)2=4×10-8;反应Cu+Cu2++2Cl-=2CuCl的平衡常数K2=1/ K=2.5×107L3/moL3;正确答案:2Cu2++2Cl-+SO2+2H2O= SO42-+2CuCl↓+ 4H+; 2.5×107L3/moL3 。
(7)铜为阳极,首先失去1个电子,变为亚铜离子,然后亚铜离子与氯离子结合生成CuCl,阳极电极反应式Cu+Cl--e-=CuCl;正确答案:Cu+Cl--e-=CuCl。


科目:高中化学 来源: 题型:
【题目】某单位为了营造节日气氛,用铝片和稀硫酸制氢气来填充气球,下列措施不能使该反应速率增大的是( )
A.加入适量NaHSO4固体B.稀硫酸改为浓硫酸
C.加热D.将铝片压薄
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积常数 | 1×10﹣14 | α | 1×10﹣12 |
试回答下列问题:
(1)若25<t1<t2 , 则α1×10﹣14(填“>”“<”或“=”),作出此判断的理由是 .
(2)25℃下,某Na2SO4溶液中c(SO42﹣)=5×10﹣4 molL﹣1 , 取该溶液1mL,加水稀释至10mL,则稀释后溶液中c (Na+):c (OH﹣)= .
(3)t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2= . 此溶液中各种离子的浓度由大到小的排列顺序是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH和NH3H2O的电离常数相等,现向10mL浓度为0.1molL﹣1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.![]() 先增大再减小
先增大再减小
C.c(CH3COOH)与c(CH3COO﹣)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂是第2周期ⅠA族元素,下列有关锂元素性质推测正确的是
A.最高化合价为+2B.原子半径比钠的大
C.单质与水的反应比钠更剧烈D.最高价氧化物对应的水化物碱性比钠的弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是铁钉在某溶液中被腐蚀的实验(开始时试管中液面和试管外液面等高). 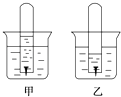
(1)甲、乙两图溶液中呈酸性的是(填“甲”或“乙”).
(2)甲图电极反应式是:正极 , 负极 .
(3)乙图中发生反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素的结构简式如图所示,下列说法错误的是( ) 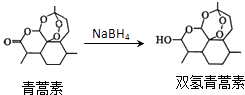
A.青蒿素易溶于苯,难溶于水
B.由青蒿素制备双氢青蒿素的反应属于 还原反应
C.青蒿素可与NaOH溶液在一定条件下发生水解反应
D.双氢青蒿素的同分异构体不可能有芳香族化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中可大量共存的离子组是( )
A.Na+、K+、Cl-、F-
B.Fe2+、ClO-、NO3-、Na+
C.Fe2+、Mg2+、SO42﹣、Cl-
D.CO32﹣、SO42﹣、Na+、K+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com