
【题目】在强酸性溶液中可大量共存的离子组是( )
A.Na+、K+、Cl-、F-
B.Fe2+、ClO-、NO3-、Na+
C.Fe2+、Mg2+、SO42﹣、Cl-
D.CO32﹣、SO42﹣、Na+、K+
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】氯化亚铜广泛应用于有机合成、石油、油脂、染料等工业。以某种铜矿粉(含Cu2S、CuS及FeS等)为原料制取CuCl的工艺流程如下:
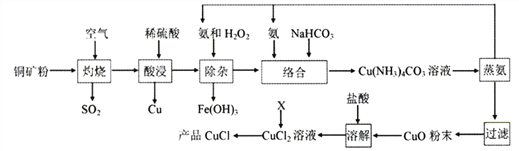
已知:①CuS、Cu2S、FeS灼烧固体产物为Cu2O、FeO;
②Ksp(CuCl)=2×10-7,2Cu+=Cu+Cu2+的平衡常数K1=1×106
回答下列问题:
(1)“灼烧”时,被还原的元素有____________(填元素符号)。
(2)“酸浸”所需H2SO4是用等体积的98%H2SO4和水混合而成。实验室配制该硫酸溶液所需的玻璃仪器除玻璃棒、胶头滴管外,还有_______。“酸浸”时硫酸不宜过多的原因是__________________。
(3)“除杂”的总反应方程式是_____________________。
(4)“络合”反应中的NH3与NaHCO3理论比值是____________________。
(5)加热“蒸氨”在减压条件下进行的原因是________________。
(6)X可以充分利用流程中的产物,若X是SO2时,通入CuCl2溶液中反应的离子方程式是________________;若X是Cu时,反应Cu+Cu2++2Cl-=2CuCl的平衡常数K2=_________。
(7)以铜为阳极电解NaCl溶液也可得到CuCl,写出阳极电极反应式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在相应的条件下可能大量共存的是( )
A.能使pH试纸变红的溶液中:CO32﹣、K+、Cl﹣、Na+
B.![]() ═10﹣10mol/L的溶液中:Na+、HCO3﹣、Cl﹣、K+
═10﹣10mol/L的溶液中:Na+、HCO3﹣、Cl﹣、K+
C.在c(OH﹣)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl﹣、NO3﹣
D.由水电离产生的c(OH﹣)=1×10﹣12mol/L的溶液中:NO3﹣、Mg2+、Na+、SO42
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用0.1mol/LHCl滴定10ml 0.05mol/L氢氧化钠溶液,若酸式滴定管未润洗,达到终点时所用盐酸的体积应是( )
A.10mL
B.5mL
C.大于5Ml
D.小于5mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物(L)是一种来源于生物学灵感的新型粘合剂,其原料取材于植物和贻贝。下列关于高聚物(L)的说法中不正确的是

A. 单体之一为![]()
B. 在一定条件下能发生水解反应
C. 生成1mol L的同时,会有(x+y-1)mol H2O生成
D. 1mol L最多可与3mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组探究电解FeCl2溶液的电极反应产物
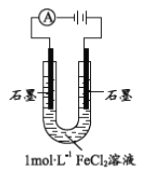
(1)配制1molL-1FeCl2溶液,测得pH=4.91,原因______(用离子方程式表示)。从化合价角度分析, Fe2+具有________。
(2)该小组同学预测电解FeCl2溶液两极的现象:阳极有黄绿色气体产生,阴极有无色气体产生。
该小组同学用右图装置电解1molL-1FeCl2溶液:
①取少量银灰色固体洗涤后,加稀H2SO4有气泡产生,再向溶液中加入________(试剂和现象),证明该固体为Fe。
②该小组同学进一步分析红褐色固体产生的原因,甲同学认为________;乙同学认为2Cl- - 2e- = Cl2↑,Cl2可氧化Fe2+最终生成Fe(OH)3 。
为证实结论,设计方案如下:用实验Ⅰ的装置和1.5v 电压,电解酸化(pH=4.91)的_______,通电5分钟后,阳极无明显现象,证实乙同学的推论不正确。丙同学认为仍不严谨,原因是产生的气体溶于水,继续实验________(操作和现象),进一步证实了乙同学的推论不正确。
(3)该小组同学进一步探究电解1molL-1FeCl2溶液电极产物的影响因素。
实验 | 条件 | 操作及现象 | ||
电压 | pH | 阳极 | 阴极 | |
Ⅰ | 1.5v | 4.91 | 无气泡产生,溶液逐渐变浑浊,5分钟后电极表面析出红褐色固体 | 无气泡产生,4分钟后电极表面有银灰色金属状固体附着 |
Ⅱ | 1.5v | 2.38 | 无气泡产生,溶液出现少量浑浊,滴加KSCN溶液变红色 | 无气泡产生,电极表面有银灰色金属状固体附着 |
Ⅲ | 1.5v | 1.00 | 无气泡产生,溶液无浑浊现象,滴加KSCN溶液变红色 | 有气泡产生,无固体附着 |
Ⅳ | 3.0v | 4.91 | 无气泡产生,溶液逐渐变浑浊,3分钟后电极表面有红褐色固体产生 | 极少量气泡产生,1分钟出现镀层金属 |
Ⅴ | 6.0v | 4.91 | 有气泡产生,遇湿润的淀粉碘化钾试纸变蓝。溶液逐渐变浑浊 | 大量气泡产生,迅速出现镀层金属 |
①对比实验Ⅰ、Ⅱ、Ⅲ可以得出结论:
阳极Fe2+放电时,酸性较强主要生成Fe3+; 酸性较弱主要生成Fe(OH)3 。阴极________。
②对比实验Ⅰ、Ⅳ、Ⅴ可以得出结论:
增大电压,不仅可以改变离子的放电能力,也可以________。
(4)综合分析上述实验,电解过程中电极反应的产物与________有关 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热N2O5时,发生以下两个反应:N2O5N2O3+O2 , N2O3N2O+O2 . 在1L密闭容器中加热4molN2O5 , 达到平衡时,c(O2)为4.5mol/L,c(N2O3) 为1.62mol/L,则c(N2O5) 为( )
A.1.44mol/L
B.3.48mol/L
C.0.94mol/L
D.1.98mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.锌粒与稀硫酸的反应
B.灼热的木炭与CO2反应
C.甲烷在氧气中的燃烧反应
D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是( )
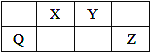
A. Q的单质具有半导体的性质,Q与Z可形成化合物QZ4
B. Q的最高价氧化物的水化物的酸性比Z的强
C. X、Y和氢3种元素形成的化合物中都只有共价键
D. Y的原子半径比X的大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com