
����Ŀ��ij�о�С��̽�����FeCl2��Һ�ĵ缫��Ӧ����
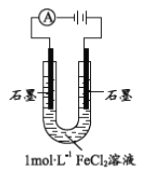
��1������1molL-1FeCl2��Һ�����pH=4.91��ԭ��______�������ӷ���ʽ��ʾ�����ӻ��ϼ۽Ƕȷ����� Fe2+����________��
��2����С��ͬѧԤ����FeCl2��Һ���������������л���ɫ�����������������ɫ���������
��С��ͬѧ����ͼװ�õ��1molL-1FeCl2��Һ��
��ȡ��������ɫ����ϴ�Ӻ�ϡH2SO4�����ݲ�����������Һ�м���________���Լ�������֤���ù���ΪFe��
�ڸ�С��ͬѧ��һ���������ɫ���������ԭ��ͬѧ��Ϊ________����ͬѧ��Ϊ2Cl- - 2e- = Cl2����Cl2������Fe2+��������Fe��OH��3 ��
Ϊ֤ʵ���ۣ���Ʒ������£���ʵ����װ�ú�1.5v ��ѹ������ữ��pH=4.91����_______��ͨ��5���Ӻ���������������֤ʵ��ͬѧ�����۲���ȷ����ͬѧ��Ϊ�Բ��Ͻ���ԭ���Dz�������������ˮ������ʵ��________��������������һ��֤ʵ����ͬѧ�����۲���ȷ��
��3����С��ͬѧ��һ��̽�����1molL-1FeCl2��Һ�缫�����Ӱ�����ء�
ʵ�� | ���� | ���������� | ||
��ѹ | pH | ���� | ���� | |
�� | 1.5v | 4.91 | �����ݲ�������Һ����ǣ�5���Ӻ�缫�����������ɫ���� | �����ݲ�����4���Ӻ�缫����������ɫ����״���帽�� |
�� | 1.5v | 2.38 | �����ݲ�������Һ�����������ǣ��μ�KSCN��Һ���ɫ | �����ݲ������缫����������ɫ����״���帽�� |
�� | 1.5v | 1.00 | �����ݲ�������Һ�������μ�KSCN��Һ���ɫ | �����ݲ��������帽�� |
�� | 3.0v | 4.91 | �����ݲ�������Һ����ǣ�3���Ӻ�缫�����к��ɫ������� | ���������ݲ�����1���ӳ��ֶƲ���� |
�� | 6.0v | 4.91 | �����ݲ�������ʪ��ĵ��۵⻯����ֽ��������Һ����� | �������ݲ�����Ѹ�ٳ��ֶƲ���� |
�ٶԱ�ʵ�������Եó����ۣ�
����Fe2+�ŵ�ʱ�����Խ�ǿ��Ҫ����Fe3+�� ���Խ�����Ҫ����Fe��OH��3 ������________��
�ڶԱ�ʵ�����������Եó����ۣ�
�����ѹ���������Ըı����ӵķŵ�������Ҳ����________��
��4���ۺϷ�������ʵ�飬�������е缫��Ӧ�IJ�����________�й� ��
���𰸡� Fe2++2H2O ![]() Fe(OH)2+2H+ �����Ժͻ�ԭ�� K3[Fe(CN)6] ��Һ����ɫ���� Fe2+-e- = Fe3+����������Fe(OH)3 2mol��L-1 NaCl����KCl����Һ ȡ����������Һ���������KI��Һ����Һ������ ���Խ�ǿʱ��H+�ŵ磬���Խ���ʱ��Fe2+�ŵ� �ı�缫��Ӧ������ �������Һ������ԡ���Դ��ѹ
Fe(OH)2+2H+ �����Ժͻ�ԭ�� K3[Fe(CN)6] ��Һ����ɫ���� Fe2+-e- = Fe3+����������Fe(OH)3 2mol��L-1 NaCl����KCl����Һ ȡ����������Һ���������KI��Һ����Һ������ ���Խ�ǿʱ��H+�ŵ磬���Խ���ʱ��Fe2+�ŵ� �ı�缫��Ӧ������ �������Һ������ԡ���Դ��ѹ
�����������⿼��ʵ�鷽����������ۣ���1��FeCl2����ǿ�������Σ�Fe2������ˮ�ⷴӦ����ԭ����Fe2++2H2O ![]() Fe(OH)2+2H+ ��Fe2�������м��̬���Ⱦ����������־��л�ԭ�ԣ���2�����������ᷴӦ����Fe2����֤������ΪFe����Ҫ��֤��Һ�д���Fe2��������Ҫ����K3[Fe(CN)6] ��Һ����Һ�г�����ɫ������֤������Ϊ�����ʣ���Fe2�����л�ԭ�ԣ�����Fe2����e��=Fe3���������Ϸ���2H2O��2e��=H2����2OH����Fe3����OH����Ӧ����Fe(OH)3����Ҫ���Ա�ʵ�飬������Cl2���������е����ӷ�����Ӧ��������ữ��2mol��L��1��NaCl��KCl����������ˮ�õ���ˮ������ǿ�����ԣ������Ҫȡ����������Һ���������KI��Һ����Һ��������֤ʵ����ͬѧ�����۲���ȷ����3���ٸ���ʵ��I��II��III�����Խ�ǿʱ�������ݲ��������帽�ţ�˵���ŵ����H�������Խ���ʱ��������ð�����н���״���帽�ţ�˵��Fe2���ŵ磻�ڸ���I��IV��Vʵ�飬���缫���������ѹ���������Ըı����ӵķŵ�˳��Ҳ���Ըı�缫�ķ�Ӧ���ʣ���4�������������缫��Ӧ�IJ�����������Һ������ԡ���Դ��ѹ�йء�
Fe(OH)2+2H+ ��Fe2�������м��̬���Ⱦ����������־��л�ԭ�ԣ���2�����������ᷴӦ����Fe2����֤������ΪFe����Ҫ��֤��Һ�д���Fe2��������Ҫ����K3[Fe(CN)6] ��Һ����Һ�г�����ɫ������֤������Ϊ�����ʣ���Fe2�����л�ԭ�ԣ�����Fe2����e��=Fe3���������Ϸ���2H2O��2e��=H2����2OH����Fe3����OH����Ӧ����Fe(OH)3����Ҫ���Ա�ʵ�飬������Cl2���������е����ӷ�����Ӧ��������ữ��2mol��L��1��NaCl��KCl����������ˮ�õ���ˮ������ǿ�����ԣ������Ҫȡ����������Һ���������KI��Һ����Һ��������֤ʵ����ͬѧ�����۲���ȷ����3���ٸ���ʵ��I��II��III�����Խ�ǿʱ�������ݲ��������帽�ţ�˵���ŵ����H�������Խ���ʱ��������ð�����н���״���帽�ţ�˵��Fe2���ŵ磻�ڸ���I��IV��Vʵ�飬���缫���������ѹ���������Ըı����ӵķŵ�˳��Ҳ���Ըı�缫�ķ�Ӧ���ʣ���4�������������缫��Ӧ�IJ�����������Һ������ԡ���Դ��ѹ�йء�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��������ij��Һ�б���ʴ��ʵ�飨��ʼʱ�Թ���Һ����Թ���Һ��ȸߣ��� 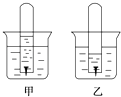
��1���ס�����ͼ��Һ�г����Ե�������ס����ҡ�����
��2����ͼ�缫��Ӧʽ�ǣ����� �� ���� ��
��3����ͼ�з�����Ӧ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ѿ��ܷⴢ��ʱ��Խ��������Խ�ã�ԭ��֮һ�Ǵ������������������ζ��������ʵ����Ҳ��������ͼ��ʾ��װ����ȡ������������ش��������⡣
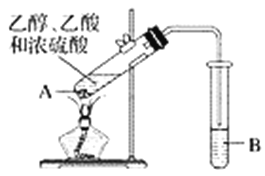
��1���Թ�A�����Һ�ļ���˳����__________________________________��
��2���Թ�A�м��뼸�����Ƭ��Ŀ����______________________��
��3���Թ�A�з�����Ӧ�Ļ�ѧ����ʽΪ______________����Ӧ������__________��
��4����Ӧ��ʼǰ���Թ�B��ʢ�ŵ���Һ��_______________________��
��5���Թ�B�п��ܹ۲쵽��������______________________________��
��6�����Թ�B�е����ʷ���õ���������������ʹ�õ�������________����������ǽ����������Ӹ�������________________________(�����¿ڷų��������Ͽڵ�����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£��ݻ��̶����ܱ����ж��ڿ��淴ӦX(g)��3Y(g) ![]() 2Z(g)����X��Y��Z����ʼŨ�ȷֱ�Ϊ c1��c2��c3(����Ϊ��)���ﵽƽ��ʱ��X��Y��Z��Ũ�ȷֱ�Ϊ0.1 mol/L��0.3 mol/L��0.08 mol/L���������жϲ���������(����)
2Z(g)����X��Y��Z����ʼŨ�ȷֱ�Ϊ c1��c2��c3(����Ϊ��)���ﵽƽ��ʱ��X��Y��Z��Ũ�ȷֱ�Ϊ0.1 mol/L��0.3 mol/L��0.08 mol/L���������жϲ���������(����)
A. c1��c2��1��3
B. ƽ��ʱ��Y��Z����������֮��Ϊ2��3
C. �ﵽƽ��ʱ�������ڵ�ѹǿ���ٱ仯
D. c1��ȡֵ��ΧΪ0 mol/L<c1<0.14 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ǿ������Һ�пɴ���������������ǣ� ��
A.Na+��K+��Cl-��F-
B.Fe2+��ClO-��NO3-��Na+
C.Fe2+��Mg2+��SO42����Cl-
D.CO32����SO42����Na+��K+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ�����ģ����ȷ����( )
A. CH4���ӵı���ģ�ͣ�![]() B. �Ҵ��Ľṹ��ʽ��C2H6O
B. �Ҵ��Ľṹ��ʽ��C2H6O
C. Al3+�Ľṹʾ��ͼ��![]() D. �Ȼ��Ƶĵ��뷽��ʽ��CaCl2===Ca2����Cl2-
D. �Ȼ��Ƶĵ��뷽��ʽ��CaCl2===Ca2����Cl2-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������з���״̬�仯ʱ���˷�������������������ͬ�����͵��ǣ� ��
A.ʳ�κ������ۻ�B.�������ƺͽ��ʯ�ۻ�
C.��ɱ�����D.����������������ۻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��Ϊ������Ԫ�أ����������ڱ������λ����ͼ��ʾ����Yԭ�ӵ��������������ڲ������������������˵����ȷ����
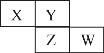
A. ԭ�Ӱ뾶��r(X)��r(Y)��r(Z)��r(W)
B. W������������Ӧˮ��������Ա�Z��ǿ
C. Z����̬�⻯����ȶ��Ա�Y����̬�⻯����ȶ���ǿ
D. X��Y�γɵĻ����ﶼ������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼ�ϵ����ȼ�ϣ���CO��H2��CH4���ȸ�O2�����������Ӧ����ѧ��ת��Ϊ���ܵ�װ�ã��������Һ��ǿ���KOH����Һ�����й��ڼ���ȼ�ϵ�ص�˵���в���ȷ���ǣ�������
A.ͨ��������һ��������ԭ��Ӧ��ͨ������һ������������Ӧ
B.�����ĵ缫��ӦʽΪCH4+10OH����8e���TCO ![]() +7H2O
+7H2O
C.���ŷ�Ӧ�Ľ��У��������Һ��pH���ֲ���
D.����ȼ�ϵ�ص����������ʱȼ���ȼ�յĴ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com