
【题目】一定条件下,容积固定的密闭容中对于可逆反应X(g)+3Y(g) ![]() 2Z(g),若X、Y、Z的起始浓度分别为 c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是( )
2Z(g),若X、Y、Z的起始浓度分别为 c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是( )
A. c1∶c2=1∶3
B. 平衡时,Y和Z的生成速率之比为2∶3
C. 达到平衡时,容器内的压强不再变化
D. c1的取值范围为0 mol/L<c1<0.14 mol/L
【答案】B
【解析】A.可根据反应转化关系和平衡浓度计算初始浓度关系;
B.达到平衡状态时,正逆反应速率相等;
C.反应前后气体的体积减小,达到平衡状态时,压强不变;
D.根据可逆反应不能完全转化的角度分析。
A.设X转化的浓度为x,则
X(g)+3Y(g) ![]() 2Z(g)
2Z(g)
初始: c1 c2 c3
转化:x 3x 2x
平衡:0.1moL/L 0.3mol/L 0.08mol/L
则:c1:c2=(x+0.1moL/L):(3x+0.3mol/L)=1:3,A正确;
B.平衡时,正逆反应速率相等,则Y和Z的生成速率之比为3:2,B错误;
C.反应前后气体的体积减小,达到平衡状态时,压强不变,C正确;
D.反应为可逆反应,物质不可能完全转化,如反应向正反应分析进行,则0<c1,如反应向逆反应分析进行,则c1<0.14molL-1,故有0<c1<0.14molL-1,D正确。
答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】能用H++OH-=H2O来表示的化学反应是( )
A.氢氧化镁和稀盐酸反应
B.Ba(OH)2溶液滴入稀硫酸中
C.澄清石灰水和稀硝酸反应
D.二氧化碳通入澄清石灰水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物N的合成路线如下图所示:
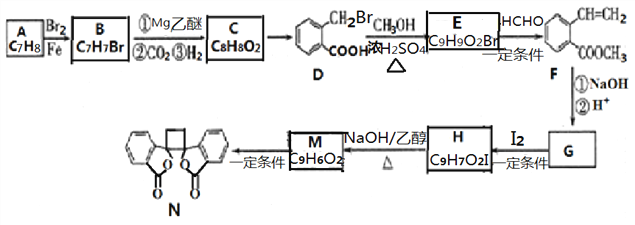
已知: i. 
ii. 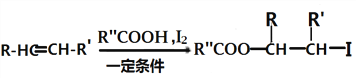
iii.  (以上R、R、R〞代表氢、烷基或芳基等)
(以上R、R、R〞代表氢、烷基或芳基等)
回答下列问题:
(1)物质B的名称是_______,物质D所含官能团的名称是_______ 。
(2)物质C的结构简式是_______。由C→D的反应类型为_______。
(3)由H生成M的化学方程式为_______。
(4)F的同分异构体中,符合下列条件的有______种(包含顺反异构),写出核磁共振氢谱有6组峰、面积比为1:1:1:2:2:3的一种有机物的结构简式____________。
条件:①分子中含有苯环,且苯环上有两个取代基②存在顺反异构
③能与碳酸氢钠反应生成CO2
(5)写出用乙烯和乙醛为原料制备化合物 的合成路线 (其他试剂任选)。________
的合成路线 (其他试剂任选)。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用0.1mol/LHCl滴定10ml 0.05mol/L氢氧化钠溶液,若酸式滴定管未润洗,达到终点时所用盐酸的体积应是( )
A.10mL
B.5mL
C.大于5Ml
D.小于5mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】匹多莫德是一种免疫调节剂,其合成路线如下:

已知:i ![]()
ii ![]()
(1)A中官能团名称________。
(2)B的结构简式________。
(3)②的反应类型________。
(4)写出谷氨酸生成F的化学方程式________。
该过程,还可能生成高聚物,写出任意一种的结构简式________。
(5)③的化学方程式________。
(6)写出半胱氨酸与HCHO反应生成G的化学方程式________。
(7)结合信息,写出以乙醇和必要无机试剂合成![]() 的路线________。
的路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组探究电解FeCl2溶液的电极反应产物
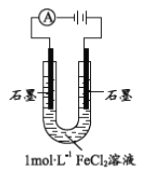
(1)配制1molL-1FeCl2溶液,测得pH=4.91,原因______(用离子方程式表示)。从化合价角度分析, Fe2+具有________。
(2)该小组同学预测电解FeCl2溶液两极的现象:阳极有黄绿色气体产生,阴极有无色气体产生。
该小组同学用右图装置电解1molL-1FeCl2溶液:
①取少量银灰色固体洗涤后,加稀H2SO4有气泡产生,再向溶液中加入________(试剂和现象),证明该固体为Fe。
②该小组同学进一步分析红褐色固体产生的原因,甲同学认为________;乙同学认为2Cl- - 2e- = Cl2↑,Cl2可氧化Fe2+最终生成Fe(OH)3 。
为证实结论,设计方案如下:用实验Ⅰ的装置和1.5v 电压,电解酸化(pH=4.91)的_______,通电5分钟后,阳极无明显现象,证实乙同学的推论不正确。丙同学认为仍不严谨,原因是产生的气体溶于水,继续实验________(操作和现象),进一步证实了乙同学的推论不正确。
(3)该小组同学进一步探究电解1molL-1FeCl2溶液电极产物的影响因素。
实验 | 条件 | 操作及现象 | ||
电压 | pH | 阳极 | 阴极 | |
Ⅰ | 1.5v | 4.91 | 无气泡产生,溶液逐渐变浑浊,5分钟后电极表面析出红褐色固体 | 无气泡产生,4分钟后电极表面有银灰色金属状固体附着 |
Ⅱ | 1.5v | 2.38 | 无气泡产生,溶液出现少量浑浊,滴加KSCN溶液变红色 | 无气泡产生,电极表面有银灰色金属状固体附着 |
Ⅲ | 1.5v | 1.00 | 无气泡产生,溶液无浑浊现象,滴加KSCN溶液变红色 | 有气泡产生,无固体附着 |
Ⅳ | 3.0v | 4.91 | 无气泡产生,溶液逐渐变浑浊,3分钟后电极表面有红褐色固体产生 | 极少量气泡产生,1分钟出现镀层金属 |
Ⅴ | 6.0v | 4.91 | 有气泡产生,遇湿润的淀粉碘化钾试纸变蓝。溶液逐渐变浑浊 | 大量气泡产生,迅速出现镀层金属 |
①对比实验Ⅰ、Ⅱ、Ⅲ可以得出结论:
阳极Fe2+放电时,酸性较强主要生成Fe3+; 酸性较弱主要生成Fe(OH)3 。阴极________。
②对比实验Ⅰ、Ⅳ、Ⅴ可以得出结论:
增大电压,不仅可以改变离子的放电能力,也可以________。
(4)综合分析上述实验,电解过程中电极反应的产物与________有关 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气作为空气污染的主要来源之一,其中含有大量的有害物质,包括CO、NOx、碳氢化合物和固体悬浮颗粒等.为汽车尾气的治理,环境工作者面临着巨大的挑战.试回答以下问题: 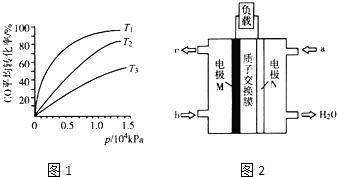
(1)用CH4催化还原NO,可以消除氮氧化物的污染.已知: ①CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJmol﹣1
②CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJmol﹣1
由CH4将NO2完全还原成N2 , 生成CO2和水蒸气的热化学方程式是 .
(2)NOx也可以被NaOH溶液吸收而生成NaNO3、NaNO2 , 已知某温度下,HNO2的电离常数K=﹣9.7×10﹣4 , NO2﹣的水解常数K=﹣8.0×10﹣10 , 则该温度下水的离子积常数=(用含Ka、Kb的代数式表示),此时溶液的温度25℃(填“>”“<”或“=”).
(3)化工上利用CO合成甲醇,反应的热化学方程式为CO(g)+2H2(g)CH3OH(g)△H=﹣90.8kJmol﹣1 . 不同温度下,CO的平衡转化率与压强的关系如图1所示,图中T1、T2、T3的高低顺序是 , 理由是 .
(4)化工上还可以利用CH3OH生产CH3OCH3 . 在体积均为1.0L的恒容密闭容器中发生反应2CH3OH(g)CH3OCH3(g)+H2O(g).
容器换号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH2(g) | H2O(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
该反应的正反应为反应(填“放热”或“吸热”).若起始时向容器I中充入CH3OH 0.15mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向方向进行(填“正”或“逆”).
(5)CH3OH燃料电池在便携式通讯设备、汽车等领域有着广泛的应用.已知电池工作时的总反应方程式为2CH3OH+3O2═2CO2+4H2O,电池工作时的示意图如图2所示.质子穿过交换膜移向电极区(填“M”或“N”),负极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2 , 负极通入丙烧,电解质是熔融碳酸盐,电池总反应方程式为:C3H8+5O2═3CO2+4H2O.
(1)已知:2C3H8(g)+7O2(g)═6CO(g)+8H2O(l)△H1C(s)+O2(g)═CO2(g)△H2
2C(s)+O2(g)═2CO(g)△H3
则 C3H8(g)+5O2((g)═3CO2(g)+4H2O(l)△H=(用△H1、△H2、△H3表示)
(2)写出该电池正极的电极反应式:,电池工作时CO32﹣移向(填“正极”或“负极”);用该电池电解1000mL lmol/L的AgNO3溶液(惰性电极),此电解池的反应方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com