
【题目】(以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2 , 负极通入丙烧,电解质是熔融碳酸盐,电池总反应方程式为:C3H8+5O2═3CO2+4H2O.
(1)已知:2C3H8(g)+7O2(g)═6CO(g)+8H2O(l)△H1C(s)+O2(g)═CO2(g)△H2
2C(s)+O2(g)═2CO(g)△H3
则 C3H8(g)+5O2((g)═3CO2(g)+4H2O(l)△H=(用△H1、△H2、△H3表示)
(2)写出该电池正极的电极反应式:,电池工作时CO32﹣移向(填“正极”或“负极”);用该电池电解1000mL lmol/L的AgNO3溶液(惰性电极),此电解池的反应方程式为 .
【答案】
(1)![]() △H1+3△H2﹣
△H1+3△H2﹣ ![]() △H3
△H3
(2)负极;4AgNO3+2H2O ![]() 4Ag+O2↑+4HNO3
4Ag+O2↑+4HNO3
【解析】解:(1)已知:①2C3H8(g)+7O2(g)═6CO(g)+8H2O(l)△H1
②C(s)+O2(g)═CO2(g)△H2
③2C(s)+O2(g)═2CO(g)△H3
依据盖斯定律:①× ![]() +②×3﹣③×
+②×3﹣③× ![]() 得到:C3H8(g)+5O2((g)═3CO2(g)+4H2O(l)△H=(
得到:C3H8(g)+5O2((g)═3CO2(g)+4H2O(l)△H=( ![]() △H1+3△H2﹣
△H1+3△H2﹣ ![]() △H3)
△H3)
所以答案是: ![]() △H1+3△H2﹣
△H1+3△H2﹣ ![]() △H3;(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融的碳酸盐.电池反应方程式为C3H8+5O2=3CO2+4H2O;正极发生还原反应,反应式为:O2+2CO2+4e﹣=2 CO32﹣;原电池中的阴离子向负极移动,放电时CO32﹣移向电池的负极,惰性电极电解1000mL1mol/L的AgNO3溶液,阳极电极反应为4OH﹣4e﹣=2H2O+O2↑,阴极电极反应为:4Ag++4e﹣=4Ag,电解池的总反应方程式为:4AgNO3+2H2O
△H3;(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融的碳酸盐.电池反应方程式为C3H8+5O2=3CO2+4H2O;正极发生还原反应,反应式为:O2+2CO2+4e﹣=2 CO32﹣;原电池中的阴离子向负极移动,放电时CO32﹣移向电池的负极,惰性电极电解1000mL1mol/L的AgNO3溶液,阳极电极反应为4OH﹣4e﹣=2H2O+O2↑,阴极电极反应为:4Ag++4e﹣=4Ag,电解池的总反应方程式为:4AgNO3+2H2O ![]() 4Ag+O2↑+4HNO3,
4Ag+O2↑+4HNO3,
所以答案是:O2+2CO2+4e﹣=2 CO32﹣;负极;4AgNO3+2H2O ![]() 4Ag+O2↑+4HNO3.
4Ag+O2↑+4HNO3.


科目:高中化学 来源: 题型:
【题目】一定条件下,容积固定的密闭容中对于可逆反应X(g)+3Y(g) ![]() 2Z(g),若X、Y、Z的起始浓度分别为 c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是( )
2Z(g),若X、Y、Z的起始浓度分别为 c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是( )
A. c1∶c2=1∶3
B. 平衡时,Y和Z的生成速率之比为2∶3
C. 达到平衡时,容器内的压强不再变化
D. c1的取值范围为0 mol/L<c1<0.14 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,若Y原子的最外层电子数是内层电子数的三倍,下列说法正确的是
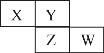
A. 原子半径:r(X)<r(Y)<r(Z)<r(W)
B. W的最高价氧化物对应水化物的酸性比Z的强
C. Z的气态氢化物的稳定性比Y的气态氢化物的稳定性强
D. X与Y形成的化合物都易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一一选修3:物质结构与性质]碳族元素的单质和化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)锗是重要半导体材料,基态Ge原子中,核外电子占据最高能级的符号是__________,该能级的电子云轮廓图为______________。金属Ge晶胞结构与金刚石类似,质地硬而脆,沸点2830℃,锗晶体属于__________晶体。
(2)①(CH3)3C+是有机合成重要中间体,该中间体中碳原子杂化方式为______________,(CH3)3C+中碳骨架的几何构型为____________________。
②治疗铅中毒可滴注依地酸钠钙,使Pb2+转化为依地酸铅盐。下列说法正确的是_______(填标号)
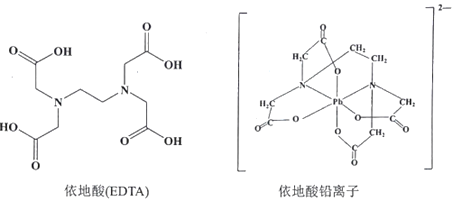
A.形成依地酸铅离子所需n(Pb2+):n(EDTA)=1:4
B.依地酸中各元素的电负性从大到小的顺序为O>N>C>H
C.依地酸铅盐中含有离子键和配位键
D.依地酸具有良好的水溶性是由于其分子间能形成氢键
(3)下表列出了碱土金属碳酸盐的热分解温度和阳离子半径:
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
阳离子半径/pm | 66 | 99 | 112 | 135 |
碱土金属碳酸盐同主族由上到下的热分解温度逐渐升高,原因是:__________________________。
(4)有机卤化铅晶体具有独特的光电性能,下图为其晶胞结构示意图:
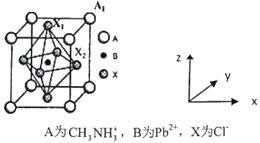
①若该晶胞的边长为anm,则Cl-间的最短距离是____________________。
②在该晶胞的另一种表达方式中,若图中Pb2+处于顶点位置,则Cl-处于_________位置。原子坐标参数B为(0,0,0);A1为(1/2,1/2,1/2),则X2为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌和二氧化锰是电池工业中主要原料,其中一种Zn﹣MnO2同槽电解的工业生产试验工艺流程涉及的主要反应有: ①MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2O ![]() MnO2+Zn+2H2SO4
MnO2+Zn+2H2SO4
下列说法正确的是( )
A.①中MnO2是氧化剂,ZnSO4是还原产物
B.①中每产生16gS时转移电子的物质的量为2mol
C.按照②电解时,生成MnO2的电极为阴极
D.该工艺流程中H2SO4可循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为主要原料合成一种具有果香味的物质C和化合物D的合成路线如下图所示。
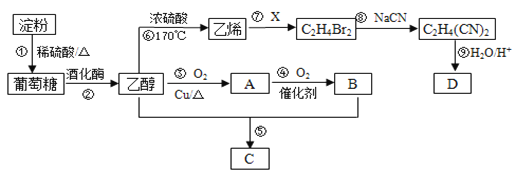
请回答下列问题:
(1)A的结构简式为_______,B分子中的官能团名称为_______。
(2)反应⑦的化学方程式为________,反应⑧的类型为_______。
(3)反应⑤的化学方程式为_________。
(4)已知D的相对分子量为118,有酸性且只含有一种官能团,其中碳、氢两元素的质量分数分别为40.68%、5.08%,其余为氧元素,则D的化学式为_______,其结构简式为______。
(5)请补充完整证明反应①是否发生的实验方案:取反应①的溶液2 mL于试管中,____________。实验中可供选择的试剂:10%的NaOH溶液、5%的CuSO4溶液、碘水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是燃料(如CO、H2、CH4)等跟O2(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱(如KOH)溶液,下列关于甲烷燃料电池的说法中不正确的是( )
A.通入氧气的一极发生还原反应,通入甲烷的一极发生氧化反应
B.负极的电极反应式为CH4+10OH﹣﹣8e﹣═CO ![]() +7H2O
+7H2O
C.随着反应的进行,电解质溶液的pH保持不变
D.甲烷燃料电池的能量利用率比甲烷燃烧的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
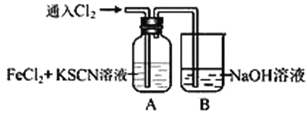
(1)B中反应的离子方程式是________________________________________________。
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在__________________。
(3)资料显示:SCN -的电子式为 ![]() 。甲同学猜想SCN―可能被Cl2氧化了,他进行了如下研究。①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN―中被氧化的元素是__________________。
。甲同学猜想SCN―可能被Cl2氧化了,他进行了如下研究。①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN―中被氧化的元素是__________________。
②甲同学通过实验证明了SCN―中氮元素转化为NO3―,已知SCN―中碳元素没有被氧化,若SCN―与Cl2反应生成0.5mol CO2,则转移电子的物质的量是_______________mol。
Ⅱ. 8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒。有少量因爆炸冲击发生泄漏。这些泄露的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染。
(1)写出NaCN的电子式__________,偏碱性条件下,氰化钠溶液的CN―被双氧水氧化为HCO3―,同时放出NH3,该反应的离子方程式:____________________________________。
(2)已知CN-离子、SCN-离子和Cl-离子有相似之处,氰分子(CN)2和硫氰分子(SCN)2的性质与Cl2也有相似之处,且常温常压均为气体,完成下列反应方程式:
①MnO2和HSCN的浓溶液共热的化学方程式方式为____________________________。
②(CN)2和NaOH溶液反应的离子反应方程式为_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com