
【题目】Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
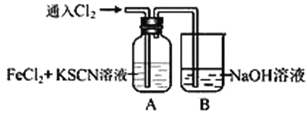
(1)B中反应的离子方程式是________________________________________________。
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在__________________。
(3)资料显示:SCN -的电子式为 ![]() 。甲同学猜想SCN―可能被Cl2氧化了,他进行了如下研究。①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN―中被氧化的元素是__________________。
。甲同学猜想SCN―可能被Cl2氧化了,他进行了如下研究。①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN―中被氧化的元素是__________________。
②甲同学通过实验证明了SCN―中氮元素转化为NO3―,已知SCN―中碳元素没有被氧化,若SCN―与Cl2反应生成0.5mol CO2,则转移电子的物质的量是_______________mol。
Ⅱ. 8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒。有少量因爆炸冲击发生泄漏。这些泄露的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染。
(1)写出NaCN的电子式__________,偏碱性条件下,氰化钠溶液的CN―被双氧水氧化为HCO3―,同时放出NH3,该反应的离子方程式:____________________________________。
(2)已知CN-离子、SCN-离子和Cl-离子有相似之处,氰分子(CN)2和硫氰分子(SCN)2的性质与Cl2也有相似之处,且常温常压均为气体,完成下列反应方程式:
①MnO2和HSCN的浓溶液共热的化学方程式方式为____________________________。
②(CN)2和NaOH溶液反应的离子反应方程式为_____________________________________。
【答案】 Cl2+2OH―═Cl―+ClO―+H2O Fe3+ 硫元素 8mol Na+[![]() CN﹣+H2O2+H2O═NH3↑+HCO3― MnO2+4HSCN(浓)
CN﹣+H2O2+H2O═NH3↑+HCO3― MnO2+4HSCN(浓)![]() Mn(SCN)2↑+(SCN)2+2H2O (CN)2+2OH-=CN-+CNO-+H2O
Mn(SCN)2↑+(SCN)2+2H2O (CN)2+2OH-=CN-+CNO-+H2O
【解析】Ⅰ.(1)B中反应的离子方程式是Cl2+2OH―═Cl―+ClO―+H2O。
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,该红褐色沉淀为氢氧化铁,说明溶液中一定存在Fe3+。
(3)由资料可知,SCN -的电子式为 ![]() ,其中S为-2价、C为+4价、N为-3价。①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,说明溶液中有硫酸根离子,由此证明SCN―中被氧化的元素是硫元素。
,其中S为-2价、C为+4价、N为-3价。①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,说明溶液中有硫酸根离子,由此证明SCN―中被氧化的元素是硫元素。
②由题意知,若SCN―与Cl2反应生成0.5mol CO2,则同时生成0.5mol NO3―和0.5mol SO42―,N由-3升高到+5、S由-2升高到+6、C的化合价不变,所以,转移电子的物质的量是8mol。
Ⅱ.(1)NaCN的电子式为Na+[![]() ,偏碱性条件下,氰化钠溶液的CN―被双氧水氧化为HCO3―,同时放出NH3,该反应的离子方程式为CN﹣+H2O2+H2O═NH3↑+HCO3―。
,偏碱性条件下,氰化钠溶液的CN―被双氧水氧化为HCO3―,同时放出NH3,该反应的离子方程式为CN﹣+H2O2+H2O═NH3↑+HCO3―。
(2)①MnO2和HSCN的浓溶液共热,类比MnO2和浓盐酸的反应,该反应的化学方程式方式为MnO2+4HSCN(浓)![]() Mn(SCN)2↑+(SCN)2+2H2O。
Mn(SCN)2↑+(SCN)2+2H2O。
②(CN)2和NaOH溶液反应,类比氯气与NaOH溶液反应,的离子反应方程式为(CN)2+2OH-=CN-+CNO-+H2O。


科目:高中化学 来源: 题型:
【题目】(以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2 , 负极通入丙烧,电解质是熔融碳酸盐,电池总反应方程式为:C3H8+5O2═3CO2+4H2O.
(1)已知:2C3H8(g)+7O2(g)═6CO(g)+8H2O(l)△H1C(s)+O2(g)═CO2(g)△H2
2C(s)+O2(g)═2CO(g)△H3
则 C3H8(g)+5O2((g)═3CO2(g)+4H2O(l)△H=(用△H1、△H2、△H3表示)
(2)写出该电池正极的电极反应式:,电池工作时CO32﹣移向(填“正极”或“负极”);用该电池电解1000mL lmol/L的AgNO3溶液(惰性电极),此电解池的反应方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将FeCl3、CuCl2混合溶液加入一定质量的铁粉中充分反应,所加混合溶液的体积与反应后剩余固体质量如图所示。已知原混合溶液中Fe3+浓度为0.200 mol/L,经检测M点时溶液中无Cu2+;
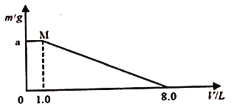
求:
(1)c(CuCl2 )=______mol·L-1。
(2)铁粉的质量_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
(1)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为______________________(写出一种即可)。
(2)25℃ 101KPa,将1molCH4与一定量的O2混合后,充入一密闭绝热容器内,在连续电火花的作用下反应,恢复至原状况放出QkJ热量,容器内无无CH4和O2剩余且无固体物质生成,装置内气体全部通入足量的碱石灰后,剩余bmol气体。则:
①反应开始时CH4与O2的物质的量之比为___________________________。
②若已知 C(s) + O2(g) = CO2(g) △H1= -m kJ/mol
CO2(g) + C(s) = 2CO(g) △H2= +n kJ/mol
则表示CH4燃烧热的热化学方程式为_____________________________________________。
(3)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应,
NO+NO2+Na2CO3===2NaNO2+CO2,2NO2+Na2CO3===NaNO2+NaNO3+CO2
① 用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则混合气体中NO和NO2的体积比为____________。
② 用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是___________________。
(4)氮的固定是几百年来科学家一直研究的课题
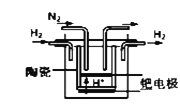
①20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如图所示,正极的电极反应式是___________________________________。
②近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)≒4NH3(g)+3O2(g),则其反应热△H=________________。
(已知:N2(g)+3H2(g)≒2NH3(g)△H=﹣92.4kJ.mol﹣1,2H2(g)+O2(g)≒2H2O(l) △H=﹣571.6kJ.mol﹣1 )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005年度的诺贝尔化学奖分别奖给美国和法国的三位科学家,表彰他们对“烯烃复分解”反应研究方面作出的贡献。“烯烃复分解”是指在金属钨或钼等催化剂的作用下,碳碳双键断裂并重新组合的过程。例如:

则对于有机物CH2=CHCH2CH=CH2发生烯烃复分解反应时可能生成产物的判断中正确的是( )
①![]() ;②CH2=CH2;③
;②CH2=CH2;③![]() ;④CH2=C=CH2
;④CH2=C=CH2
A. 只有①②③ B. 只有①② C. 只有③ D. 只有③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)D在周期表中的位置___________;
(2)元素C、D、E形成的原子半径大小关系是______________(用元素符号表示)。
(3)C、D可形成化合物D2C2,D2C2含有的化学键类型有______________________;
(4)A、C两种元素形成的原子个数之比为1:1的化合物电子式________________;
(5)B的氢化物与B的最高价氧化物的水化物反应的离子方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为112的有机物X完全燃烧只生成CO2和H2O,若X含一个六元碳环且可以发生银镜反应,则环上一溴代物的种类为( )
A.2
B.3
C.4
D.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液既能溶解Al(OH)3,又能溶解Al,但不能溶解Fe,该溶液中可以大量共存的离子组是( )
A. K+、Na+、HCO![]() 、NO
、NO![]() B. Na+、SO
B. Na+、SO![]() 、Cl-、S2-
、Cl-、S2-
C. NH![]() 、Mg2+、SO
、Mg2+、SO![]() 、NO
、NO![]() D. K+、Ca2+、Cl-、Na+
D. K+、Ca2+、Cl-、Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com