
【题目】以淀粉为主要原料合成一种具有果香味的物质C和化合物D的合成路线如下图所示。
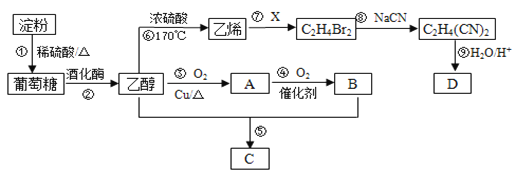
请回答下列问题:
(1)A的结构简式为_______,B分子中的官能团名称为_______。
(2)反应⑦的化学方程式为________,反应⑧的类型为_______。
(3)反应⑤的化学方程式为_________。
(4)已知D的相对分子量为118,有酸性且只含有一种官能团,其中碳、氢两元素的质量分数分别为40.68%、5.08%,其余为氧元素,则D的化学式为_______,其结构简式为______。
(5)请补充完整证明反应①是否发生的实验方案:取反应①的溶液2 mL于试管中,____________。实验中可供选择的试剂:10%的NaOH溶液、5%的CuSO4溶液、碘水
【答案】 CH3CHO 羧基 CH2=CH2 +Br2 → CH2BrCH2Br 取代反应 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O C4H6O4 HOOC-CH2-CH2-COOH 用10%的NaOH溶液调节溶液至中性(或碱性),再向其中加入2 mL 10%的NaOH溶液,再加入4~5滴5%的CuSO4溶液,加热一段时间。若有砖红色沉淀,则证明反应①已发生。
CH3COOCH2CH3+H2O C4H6O4 HOOC-CH2-CH2-COOH 用10%的NaOH溶液调节溶液至中性(或碱性),再向其中加入2 mL 10%的NaOH溶液,再加入4~5滴5%的CuSO4溶液,加热一段时间。若有砖红色沉淀,则证明反应①已发生。
【解析】CH3CH2OH在Cu催化剂条件下发生催化氧化生成A为CH3CHO,CH3CHO进一步氧化生成B为CH3COOH,CH3COOH与CH3CH2OH发生酯化反应生成C为CH3COOC2H5,乙醇发生消去反应生成乙烯,乙烯与Br2发生加成反应生成BrCH2CH2Br,BrCH2CH2Br与NaCN发生取代反应生成NC-CH2CH2-CN,(4)中D的相对分子量为118,其中碳、氢两元素的质量分数分别为40.68%、5.08%,其余为氧元素,则分子中N(C)=![]() =4、N(H)=
=4、N(H)=![]() =6、N(O)=
=6、N(O)=![]() =4,故D的分子式为C4H6O4,则其结构简式为HOOC-CH2CH2-COOH。
=4,故D的分子式为C4H6O4,则其结构简式为HOOC-CH2CH2-COOH。
(1)A的结构简式为CH3CHO,B为CH3COOH,B中的官能团为羧基,故答案为:CH3CHO;羧基;
(2)反应⑦为乙烯与溴的加成反应,反应的方程式为CH2=CH2 +Br2 → CH2BrCH2Br,根据上述分析,反应⑧为取代反应,故答案为:CH2=CH2 +Br2 → CH2BrCH2Br;取代反应;
(3)反应⑤的化学方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(4)由上述分析可知,D的分子式为:C4H6O4,结构简式为HOOC-CH2-CH2-COOH,故答案为:C4H6O4;HOOC-CH2-CH2-COOH;
(5)反应①是淀粉水解生成葡萄糖,葡萄糖中含有醛基,检验否发生的实验方案:取反应①的溶液2mL于试管中,用10%的NaOH溶液调节溶液至中性,再向其中加入2 mL 10%的NaOH溶液,再加入4~5滴5%的CuSO4溶液,加热一段时间.若有砖红色沉淀,则证明反应①已发生,故答案为:用10%的NaOH溶液调节溶液至中性,再向其中加入2 mL 10%的NaOH溶液,再加入4~5滴5%的CuSO4溶液,加热一段时间。若有砖红色沉淀,则证明反应①已发生。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】匹多莫德是一种免疫调节剂,其合成路线如下:

已知:i ![]()
ii ![]()
(1)A中官能团名称________。
(2)B的结构简式________。
(3)②的反应类型________。
(4)写出谷氨酸生成F的化学方程式________。
该过程,还可能生成高聚物,写出任意一种的结构简式________。
(5)③的化学方程式________。
(6)写出半胱氨酸与HCHO反应生成G的化学方程式________。
(7)结合信息,写出以乙醇和必要无机试剂合成![]() 的路线________。
的路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.将纯水加热的过程中,Kw变大,pH变小
B.保存FeSO4溶液时,加入稀HNO3抑制Fe2+水解
C.FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体
D.向0.1 molL﹣1氨水中加入少量水,pH减小, ![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1molH2O的质量是18g
B.氮原子的质量就是氮的相对原子质量
C.1molH2SO4中含1molH2
D.氢氧化钠的摩尔质量是40g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2 , 负极通入丙烧,电解质是熔融碳酸盐,电池总反应方程式为:C3H8+5O2═3CO2+4H2O.
(1)已知:2C3H8(g)+7O2(g)═6CO(g)+8H2O(l)△H1C(s)+O2(g)═CO2(g)△H2
2C(s)+O2(g)═2CO(g)△H3
则 C3H8(g)+5O2((g)═3CO2(g)+4H2O(l)△H=(用△H1、△H2、△H3表示)
(2)写出该电池正极的电极反应式:,电池工作时CO32﹣移向(填“正极”或“负极”);用该电池电解1000mL lmol/L的AgNO3溶液(惰性电极),此电解池的反应方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用木质纤维可合成药物中间体H,还能合成高分子化合物G,合成路线如下:

已知:
①![]() ②
②![]()
(1)A的化学名称是___________________。
(2)B的结构简式是_____________,由C生成D的反应类型为_____________________。
(3)化合物E的官能团为__________________________。
(4)F分子中处于同一平面的原子最多有___________个。F生成G的化学反应方程式为_________________________________。
(5)芳香化合物I为H的同分异构体,苯环上一氯代物有两种结构,1molI发生水解反应消耗2mol NaOH,符合要求的同分异构体有______种,其中核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:3:2:1的I结构简式为__________________________。
(6)写出用 为原料制备
为原料制备![]() 的合成路线(其他试剂任选)__________。
的合成路线(其他试剂任选)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各装置图的叙述中,不正确的是( )
A.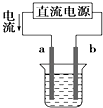 如图装置中a为阳极、b为阴极
如图装置中a为阳极、b为阴极
B.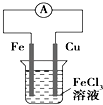 如图装置的总反应是:Cu+2Fe3+=Cu2++2Fe2+
如图装置的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.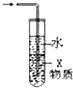 如图装置中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
如图装置中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D. 如图装置中的铁钉几乎不被腐蚀
如图装置中的铁钉几乎不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:

已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,TiOSO4遇水会水解。请回答下列问题:
(1)操作1用到的玻璃仪器除烧杯外还有_________;
(2)请结合化学用语解释将TiO2+转化为H2TiO3的原理_______________。
(3)已知钛的还原性介于铝与锌之间。如果可从Na、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是____________。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式是___________________________________。
(5)为测定溶液中TiOSO4的含量,先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3TiO2+ +Al+6H+=3Ti3++Al3++3H2O。过滤后,取无色滤液20.00 mL,向其中滴加2~3滴KSCN溶液作指示剂,用______________________(填一种玻璃仪器的名称)滴加0.1000mol·L-1 FeCl3溶液,发生Ti3++Fe3+=Ti4++Fe2+。滴定终点时的现象是___________________________________,若用去了30.00mL FeC13溶液,待测钛液中TiOSO4的物质的量浓度是______________mol/L。
【答案】 漏斗、玻璃棒 溶液中存在平衡:TiO2++2H2O![]() H2TiO3+2H+,当加入水稀释、升温后,平衡正向移动 TiCl4+4Na
H2TiO3+2H+,当加入水稀释、升温后,平衡正向移动 TiCl4+4Na![]() Ti+4NaCl TiO2 + 4e- = Ti + 2O2- 酸式滴定管 溶液由无色变成红色且半分钟不褪色 1.50 mol/L
Ti+4NaCl TiO2 + 4e- = Ti + 2O2- 酸式滴定管 溶液由无色变成红色且半分钟不褪色 1.50 mol/L
【解析】钛铁矿用浓硫酸溶解,浓硫酸具有酸性,强氧化性,反应的主要产物是TiOSO4和FeSO4,还可能有少量Fe2(SO4)3;向所得溶液中加入大量水稀释后,加入过量铁粉还原Fe3+,过滤得到滤液中只含有TiOSO4和FeSO4;TiOSO4水解过滤后得到H2TiO3,H2TiO3加热灼烧得到TiO2,加入Cl2、过量碳高温反应生成TiCl4,TiCl4和Mg高温反应得到MgCl2和Ti。
(1)操作1为过滤,所需玻璃仪器有烧杯、漏斗、玻璃棒,故还缺少的仪器为:漏斗和玻璃棒;故答案为:漏斗、玻璃棒;
(2)TiOSO4遇水会水解,水解方程式为TiO2++2H2OH2TiO3+2H+,水解是吸热过程,加热能促进水解;加水稀释,促进水解。
故答案为:溶液中存在平衡:TiO2++2H2OH2TiO3+2H+,当加入水稀释、升温后,平衡正向移动;
(3)在流程中,金属镁置换出钛单质,反应方程式为:TiCl4+2Mg![]() Ti+2MgCl2。钛的还原性介于铝与锌之间,即还原性:Al>Ti>Zn,又因为还原性Na>Al>Zn>Fe,则Na>Al>Ti>Zn>Fe,故Na、Zn、Fe三种金属中只能选择金属Na代替镁。反应方程式为:TiCl4+4Na
Ti+2MgCl2。钛的还原性介于铝与锌之间,即还原性:Al>Ti>Zn,又因为还原性Na>Al>Zn>Fe,则Na>Al>Ti>Zn>Fe,故Na、Zn、Fe三种金属中只能选择金属Na代替镁。反应方程式为:TiCl4+4Na
![]() Ti+4NaCl。
Ti+4NaCl。
故答案为:TiCl4+4Na![]() Ti+4NaCl;
Ti+4NaCl;
(4)根据题意可知,TiO2作阴极,得电子,被还原得到单质Ti,则阴极电极反应式为:TiO2+4e-=Ti+2O2-。故答案为:TiO2+4e-=Ti+2O2-;
(5)FeC13有强的氧化性,腐蚀橡胶,且其溶液呈酸性,所以选择酸式滴定管。用KSCN溶液作指示剂,TiO2+反应完之前溶液为无色。当反应完,再滴入1滴FeC13溶液,溶液立即变红色,且半分钟后溶液颜色不褪色,到达滴定终点,停止滴定。
滴定过程中消耗n(FeC13)=0.1mol/L×0.03L=0.003mol。根据反应方程式可得出TiOSO4与Fe3+的关系式:TiOSO4~Ti3+~Fe3+,即滴定过程中n(FeC13)= n(TiOSO4)= 0.003mol。原待测液为10mL,稀释至100mL后,取2omL溶液进行滴定实验。所以原10mL待测液中含n(TiOSO4)= 0.003mol×![]() =0.015mol,c(TiOSO4)=
=0.015mol,c(TiOSO4)= ![]() =1.5 molL-1。
=1.5 molL-1。
故答案为:酸式滴定管;溶液由无色变成红色且半分钟不褪色 ;1.5 molL-1.
【题型】综合题
【结束】
11
【题目】Fe3+与CN-、F-、有机分子等形成的化合物具有广泛的应用。
(1)Fe3+基态核外电子排布式为________。
(2)乙酰基二茂铁是常用汽油抗震剂,其结构如图甲所示。此物质中碳原子的杂化方式是__________。
(3)C、N、O原子的第一电离能由大到小的顺序是___________________________。
(4)配合物K3Fe(CN)6可用于电子传感器的制作。与配体互为等电子体的一种分子的化学式为________________。已知(CN)2是直线形分子,并具有对称性,则(CN)2中π键和σ键的个数比为__________________。
(5)F-不仅可与Fe3+形成3-,还可以与Mg2+、K+形成一种立方晶系的离子晶体,此晶体应用于激光领域,其结构如图乙所示,则该晶体的化学式为__________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005年度的诺贝尔化学奖分别奖给美国和法国的三位科学家,表彰他们对“烯烃复分解”反应研究方面作出的贡献。“烯烃复分解”是指在金属钨或钼等催化剂的作用下,碳碳双键断裂并重新组合的过程。例如:

则对于有机物CH2=CHCH2CH=CH2发生烯烃复分解反应时可能生成产物的判断中正确的是( )
①![]() ;②CH2=CH2;③
;②CH2=CH2;③![]() ;④CH2=C=CH2
;④CH2=C=CH2
A. 只有①②③ B. 只有①② C. 只有③ D. 只有③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com