
【题目】下列说法正确的是( )
A.1molH2O的质量是18g
B.氮原子的质量就是氮的相对原子质量
C.1molH2SO4中含1molH2
D.氢氧化钠的摩尔质量是40g
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】关于A(g)+2B(g)═3C(g)的化学反应,下列表示的反应速率最大的是( )
A.v(A)=0.6mol/(Lmin)
B.v(B)=1.2mol/(Lmin)
C.v(C)=1.2mol/(Lmin)
D.v(B)=0.03mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A,B,C,D分别是Cu、Ag、Fe、Al四种金属中的一种.已知①A,C均能与稀硫酸反应放出气体;②B与D的硝酸盐反应,置换出单质D;③C与强碱反应放出气体,由此可以推断A,B,C,D依次是( )
A.Fe、Cu、Al、Ag
B.Al、Cu、Fe、Ag
C.Cu、Ag、Al、Fe
D.Ag、Al、Cu、Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,两个微粒一定不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
C.最外层电子数是核外电子总数的1/5的原子和价电子排布为4s24p5的原子
D.2p能级有一个未成对电子的基态原子和原子的价电子排布为2s22p5的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一一选修3:物质结构与性质]碳族元素的单质和化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)锗是重要半导体材料,基态Ge原子中,核外电子占据最高能级的符号是__________,该能级的电子云轮廓图为______________。金属Ge晶胞结构与金刚石类似,质地硬而脆,沸点2830℃,锗晶体属于__________晶体。
(2)①(CH3)3C+是有机合成重要中间体,该中间体中碳原子杂化方式为______________,(CH3)3C+中碳骨架的几何构型为____________________。
②治疗铅中毒可滴注依地酸钠钙,使Pb2+转化为依地酸铅盐。下列说法正确的是_______(填标号)
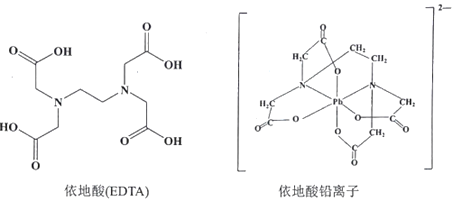
A.形成依地酸铅离子所需n(Pb2+):n(EDTA)=1:4
B.依地酸中各元素的电负性从大到小的顺序为O>N>C>H
C.依地酸铅盐中含有离子键和配位键
D.依地酸具有良好的水溶性是由于其分子间能形成氢键
(3)下表列出了碱土金属碳酸盐的热分解温度和阳离子半径:
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
阳离子半径/pm | 66 | 99 | 112 | 135 |
碱土金属碳酸盐同主族由上到下的热分解温度逐渐升高,原因是:__________________________。
(4)有机卤化铅晶体具有独特的光电性能,下图为其晶胞结构示意图:
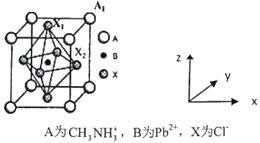
①若该晶胞的边长为anm,则Cl-间的最短距离是____________________。
②在该晶胞的另一种表达方式中,若图中Pb2+处于顶点位置,则Cl-处于_________位置。原子坐标参数B为(0,0,0);A1为(1/2,1/2,1/2),则X2为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度时,用惰性电极电解硝酸钠的不饱和溶液.若两极板收集到气体总体积为22.4aL时,剩余溶液恢复至原温度,析出溶质mg(溶质不带结晶水);若两极收集到气体总体积为33.6aL时,剩余溶液恢复至原温度,析出溶质ng.则硝酸钠在该温度时的溶解度是(气体体积均已折合为标准状况下的体积)( )
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为主要原料合成一种具有果香味的物质C和化合物D的合成路线如下图所示。
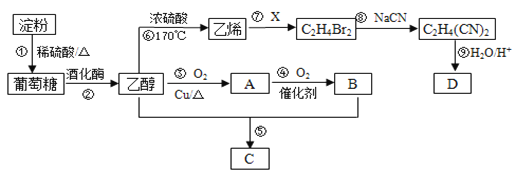
请回答下列问题:
(1)A的结构简式为_______,B分子中的官能团名称为_______。
(2)反应⑦的化学方程式为________,反应⑧的类型为_______。
(3)反应⑤的化学方程式为_________。
(4)已知D的相对分子量为118,有酸性且只含有一种官能团,其中碳、氢两元素的质量分数分别为40.68%、5.08%,其余为氧元素,则D的化学式为_______,其结构简式为______。
(5)请补充完整证明反应①是否发生的实验方案:取反应①的溶液2 mL于试管中,____________。实验中可供选择的试剂:10%的NaOH溶液、5%的CuSO4溶液、碘水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O。下列有关说法正确的是 ( )
A. 由反应可确定:氧化产物是HClO4
B. 由非金属性Cl>S,可推知酸性HClO3>H2SO4
C. 若化学计量数a=8,b=3,则该反应转移电子数为8e-
D. 若该反应所得lmol混合气体质量为45g,则反应可表示为:3HClO3 = 2O2↑+ C12↑+ HClO4 + H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com