
【题目】锌和二氧化锰是电池工业中主要原料,其中一种Zn﹣MnO2同槽电解的工业生产试验工艺流程涉及的主要反应有: ①MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2O ![]() MnO2+Zn+2H2SO4
MnO2+Zn+2H2SO4
下列说法正确的是( )
A.①中MnO2是氧化剂,ZnSO4是还原产物
B.①中每产生16gS时转移电子的物质的量为2mol
C.按照②电解时,生成MnO2的电极为阴极
D.该工艺流程中H2SO4可循环
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:
【题目】现用0.1mol/LHCl滴定10ml 0.05mol/L氢氧化钠溶液,若酸式滴定管未润洗,达到终点时所用盐酸的体积应是( )
A.10mL
B.5mL
C.大于5Ml
D.小于5mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.锌粒与稀硫酸的反应
B.灼热的木炭与CO2反应
C.甲烷在氧气中的燃烧反应
D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)==2C(g)+D(g),经2min后B的浓度减少0.6mol·L-1,下列说法正确的是
A. 用A表示的反应速率是0.4mol·L-1·min-1
B. 在2min末的反应速率,用B表示是0.3 mol·L-1·min-1
C. 分别用B、C、D表示反应的速率,其比值是3:2:1
D. 在这2min内B和C两物质浓度是逐渐减小的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2 , 负极通入丙烧,电解质是熔融碳酸盐,电池总反应方程式为:C3H8+5O2═3CO2+4H2O.
(1)已知:2C3H8(g)+7O2(g)═6CO(g)+8H2O(l)△H1C(s)+O2(g)═CO2(g)△H2
2C(s)+O2(g)═2CO(g)△H3
则 C3H8(g)+5O2((g)═3CO2(g)+4H2O(l)△H=(用△H1、△H2、△H3表示)
(2)写出该电池正极的电极反应式:,电池工作时CO32﹣移向(填“正极”或“负极”);用该电池电解1000mL lmol/L的AgNO3溶液(惰性电极),此电解池的反应方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是( )
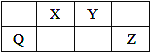
A. Q的单质具有半导体的性质,Q与Z可形成化合物QZ4
B. Q的最高价氧化物的水化物的酸性比Z的强
C. X、Y和氢3种元素形成的化合物中都只有共价键
D. Y的原子半径比X的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100mL 0.01molL﹣1的HA溶液中逐滴加入0.02molL﹣1的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( ) 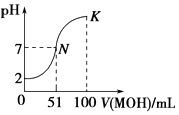
A.HA为弱酸
B.常温下,MA溶液的pH>7
C.K点对应的溶液中:c(M+)+c(MOH)=c(A﹣)
D.在N到K间任意一点对应的溶液中:c(M+)+c(H+)=c(OH﹣)+c(A﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
(1)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为______________________(写出一种即可)。
(2)25℃ 101KPa,将1molCH4与一定量的O2混合后,充入一密闭绝热容器内,在连续电火花的作用下反应,恢复至原状况放出QkJ热量,容器内无无CH4和O2剩余且无固体物质生成,装置内气体全部通入足量的碱石灰后,剩余bmol气体。则:
①反应开始时CH4与O2的物质的量之比为___________________________。
②若已知 C(s) + O2(g) = CO2(g) △H1= -m kJ/mol
CO2(g) + C(s) = 2CO(g) △H2= +n kJ/mol
则表示CH4燃烧热的热化学方程式为_____________________________________________。
(3)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应,
NO+NO2+Na2CO3===2NaNO2+CO2,2NO2+Na2CO3===NaNO2+NaNO3+CO2
① 用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则混合气体中NO和NO2的体积比为____________。
② 用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是___________________。
(4)氮的固定是几百年来科学家一直研究的课题
①20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如图所示,正极的电极反应式是___________________________________。
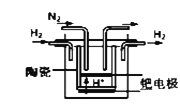
②近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)≒4NH3(g)+3O2(g),则其反应热△H=________________。
(已知:N2(g)+3H2(g)≒2NH3(g)△H=﹣92.4kJ.mol﹣1,2H2(g)+O2(g)≒2H2O(l) △H=﹣571.6kJ.mol﹣1 )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com