
【题目】Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是( )
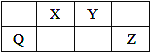
A. Q的单质具有半导体的性质,Q与Z可形成化合物QZ4
B. Q的最高价氧化物的水化物的酸性比Z的强
C. X、Y和氢3种元素形成的化合物中都只有共价键
D. Y的原子半径比X的大
【答案】A
【解析】由Q、X、Y和Z为短周期元素及它们在周期表中的位置可知,X、Y位于第二周期,Q、Z位于第三周期,设X的最外层电子数为x,4种元素的原子最外层电子数之和为22,则x-1+x+x+1+x+2=22,解得x=5,可知X为N、Y为O、Q为Si、Z为Cl,以此来解答。
由上述分析可知,X为N、Y为O、Q为Si、Z为Cl,则
A.Si位于金属与非金属的交界处,具有半导体的性质,且Si为+4价,Cl为-1价时Q与Z可形成化合物SiCl4,A正确;
B.同周期从左向右非金属性逐渐增强,非金属性越强,对应最高价含氧酸的酸性越强,则Q的最高价氧化物的水化物的酸性比Z的弱,B错误;
C.X、Y和氢3种元素形成的化合物若为硝酸铵,含离子键、共价键,C错误;
D.同周期从左向右原子半径逐渐减小,则Y的原子半径比X的小,D错误;
答案选A。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】在强酸性溶液中可大量共存的离子组是( )
A.Na+、K+、Cl-、F-
B.Fe2+、ClO-、NO3-、Na+
C.Fe2+、Mg2+、SO42﹣、Cl-
D.CO32﹣、SO42﹣、Na+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌和二氧化锰是电池工业中主要原料,其中一种Zn﹣MnO2同槽电解的工业生产试验工艺流程涉及的主要反应有: ①MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2O ![]() MnO2+Zn+2H2SO4
MnO2+Zn+2H2SO4
下列说法正确的是( )
A.①中MnO2是氧化剂,ZnSO4是还原产物
B.①中每产生16gS时转移电子的物质的量为2mol
C.按照②电解时,生成MnO2的电极为阴极
D.该工艺流程中H2SO4可循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用下图装置进行实验,试回答:
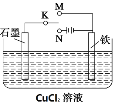
(1)若开始时K接M,则该装置为________(填“原电池”或“电解池”)铁极上的电极反应式为________。
(2)若开始时K接N,则石墨极为______极(填“正”、“负”、“阳” 或“阴”),装置中的总化学方程式为________,铁极上的现象为________,石墨电极的反应现象为________,若反应过程中有0.1mol的电子发生转移,则铁电极上产生物质的质量为____g,石墨极上产生的物质在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是燃料(如CO、H2、CH4)等跟O2(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱(如KOH)溶液,下列关于甲烷燃料电池的说法中不正确的是( )
A.通入氧气的一极发生还原反应,通入甲烷的一极发生氧化反应
B.负极的电极反应式为CH4+10OH﹣﹣8e﹣═CO ![]() +7H2O
+7H2O
C.随着反应的进行,电解质溶液的pH保持不变
D.甲烷燃料电池的能量利用率比甲烷燃烧的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知NA为阿伏加德罗常数的数值,下列说法正确的是
A. 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
B. 一定条件下在密闭容器中2 molSO2与2 molO2充分反应,最终的气体分子数为3NA
C. 将lmolNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
D. 4.6g乙醇含有共价键的数目为0.9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。现利用下图所示装置进行实验。
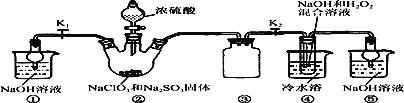
(1)装置③的作用是__________________________。
(2)装置②中产生ClO2的化学方程式为_______________________________________;装置④中制备NaClO2的离子方程式为____________________________________________。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55 ℃蒸发结晶;② 趁热过滤;③________________;④ 低于60 ℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO![]() +4I-+4H+===2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O
+4I-+4H+===2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() )。
)。
(4)配制待测液时,除用到烧杯、玻璃棒外,还必须用到的玻璃仪器有_________。
(5)该样品中NaClO2的质量分数为__________________(用含m、c、V的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com