
【题目】己知NA为阿伏加德罗常数的数值,下列说法正确的是
A. 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
B. 一定条件下在密闭容器中2 molSO2与2 molO2充分反应,最终的气体分子数为3NA
C. 将lmolNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
D. 4.6g乙醇含有共价键的数目为0.9NA
【答案】C
【解析】A. 25℃时,pH=13的1.0LBa(OH)2溶液中c(OH-)=0.1mol/L,n(OH-)=0.1mol/L×1L=0.1mol,含有的OH-数目为0.1NA,故A错误;B. 二氧化硫与氧气的反应属于可逆反应,不能完全进行,一定条件下在密闭容器中2 molSO2与2 molO2充分反应,最终的气体分子数大于3NA,故B错误;C. 将lmolNH4NO3溶于稀氨水中使溶液呈中性,溶液中存在电荷守恒,c(NH4+)+c(H+)=c(OH-)+c(NO3-),溶液显中性,c(H+)=c(OH-),则c(NH4+)=c(NO3-),NH4+数目为NA,故C正确;D. 4.6g乙醇的物质的量为![]() =0.1mol,含有共价键的物质的量为0.1mol×
=0.1mol,含有共价键的物质的量为0.1mol×![]() ×(2×4+2×1+6×1)=0.8mol,故D错误;故选C。
×(2×4+2×1+6×1)=0.8mol,故D错误;故选C。
点晴:顺利解答该类题目的关键是:一方面要仔细审题,注意关键字词,熟悉常见的“陷阱”;另一方面是要把各种量转化为物质的量,以此为中心进行计算。本题的易错点是A,注意不能被氢氧化钡是二元碱所迷惑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】加热N2O5时,发生以下两个反应:N2O5N2O3+O2 , N2O3N2O+O2 . 在1L密闭容器中加热4molN2O5 , 达到平衡时,c(O2)为4.5mol/L,c(N2O3) 为1.62mol/L,则c(N2O5) 为( )
A.1.44mol/L
B.3.48mol/L
C.0.94mol/L
D.1.98mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是( )
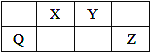
A. Q的单质具有半导体的性质,Q与Z可形成化合物QZ4
B. Q的最高价氧化物的水化物的酸性比Z的强
C. X、Y和氢3种元素形成的化合物中都只有共价键
D. Y的原子半径比X的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Na+、Al3+、Cl-、SO42﹣ 四种离子,已知前三种离子的个数比为3:2:1,则溶液中Na+和SO42﹣的离子个数比为( )
A.1: 2
B.1:4
C.3:4
D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100mL 0.01molL﹣1的HA溶液中逐滴加入0.02molL﹣1的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( ) 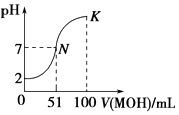
A.HA为弱酸
B.常温下,MA溶液的pH>7
C.K点对应的溶液中:c(M+)+c(MOH)=c(A﹣)
D.在N到K间任意一点对应的溶液中:c(M+)+c(H+)=c(OH﹣)+c(A﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联合国气候变化大会于2009年12月7~18日在哥本哈根召开.中国政府承诺到2020年,单位GDP二氧化碳排放比2005年下降40%~45%. 电解
(1)有效“减碳”的手段之一是节能.下列制氢方法最符合的是(填字母序号).
A.电解水制氢:2H2O= ![]() 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O= ![]() 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O ![]() CO+3H2
CO+3H2
(2)用CO2和氢气合成CH3OCH3(甲 醚 )是解决能源危机的研究方向之一. 已知:
CO(g)+2H2(g)═CH3OH(g)△H=Q1 kJmol﹣1
2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=Q2 kJmol﹣1
CO(g)+H2O(g)═CO2(g)+H2(g)△H=Q3 kJmol﹣1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为 .
(3)在催化剂和一定温度、压强条件下,CO与H2可反应生成甲醇:CO(g)+2H2(g)CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:p1p2 (填“>”、“<”或“=”),上述反应的△H0 (填“<”、“>”或“=”) 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)26H2O]又名摩尔盐,是浅绿色晶体,易溶于水,是分析化学中的重要试剂。某化学兴趣小组对摩尔盐的一些性质进行探究。回答下列问题:
(1)在试管中加入少量摩尔盐晶体,加水溶解,测得水溶液呈酸性。由此可知________。
(2)摩尔盐在500℃时隔绝空气加热完全分解,气体产物可能有NH3、SO2、SO3、H2O等。兴趣小组利用下图装置证明摩尔盐分解的气体产物中有SO2和SO3。

①a的名称是________。装置B的作用________。
②装置连接顺序为A→____→____→____→____(填字母序号)。
③能证明分解产物中有SO2的实验现象是________,反应的离子方程式是________。
④若装置连接顺序不变,能否将装置E中溶液换为BaCl2溶液?理由是________。
(3)为判断摩尔盐是否变质,可以测定样品中Fe2+的含量。取w g样品溶于水,配制成250 mL溶液。每次取25.00 mL溶液,用c mol/L的酸性KMnO4溶液滴定,滴定三次,平均消耗KMnO4溶液体积 v mL。
①滴定时,用________(填“酸式”或“碱式”)滴定管盛装KMnO4溶液。
②样品中Fe2+的质量分数为________(用含w、c、v的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com