
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)26H2O]又名摩尔盐,是浅绿色晶体,易溶于水,是分析化学中的重要试剂。某化学兴趣小组对摩尔盐的一些性质进行探究。回答下列问题:
(1)在试管中加入少量摩尔盐晶体,加水溶解,测得水溶液呈酸性。由此可知________。
(2)摩尔盐在500℃时隔绝空气加热完全分解,气体产物可能有NH3、SO2、SO3、H2O等。兴趣小组利用下图装置证明摩尔盐分解的气体产物中有SO2和SO3。

①a的名称是________。装置B的作用________。
②装置连接顺序为A→____→____→____→____(填字母序号)。
③能证明分解产物中有SO2的实验现象是________,反应的离子方程式是________。
④若装置连接顺序不变,能否将装置E中溶液换为BaCl2溶液?理由是________。
(3)为判断摩尔盐是否变质,可以测定样品中Fe2+的含量。取w g样品溶于水,配制成250 mL溶液。每次取25.00 mL溶液,用c mol/L的酸性KMnO4溶液滴定,滴定三次,平均消耗KMnO4溶液体积 v mL。
①滴定时,用________(填“酸式”或“碱式”)滴定管盛装KMnO4溶液。
②样品中Fe2+的质量分数为________(用含w、c、v的式子表示)。
【答案】 NH4+和 Fe2+水解使溶液成酸性 硬质玻璃管 防液体倒吸入硬质玻璃管中 BEDC D 中出现白色沉淀 SO2+H2O2+Ba2+=BaSO4↓+2H+ 不能,在有 NH3存在下, SO2会与 BaCl2溶液反应生成 BaSO3沉淀, 干扰 SO3的检验 酸式 ![]()
【解析】(1)在试管中加入少量摩尔盐晶体,加水溶解,测得水溶液呈酸性。由此可知NH4+和 Fe2+水解使溶液成酸性;(2)①a的名称是硬质玻璃管。装置B为安全瓶,其作用防液体倒吸入硬质玻璃管中;②分解得到的气体进入B后再通入装置E以检验三氧化硫,再进入D以检验二氧化硫,最后尾气利用足量氢氧化钠溶液吸收,装置连接顺序为A→B→E→D→C;③能证明分解产物中有SO2的实验现象是D 中出现白色沉淀,反应的离子方程式是SO2+H2O2+Ba2+=BaSO4↓+2H+;④若装置连接顺序不变,不能将装置E中溶液换为BaCl2溶液,因为在有 NH3存在下,SO2会与BaCl2溶液反应生成 BaSO3沉淀,干扰SO3的检验;(3)①KMnO4溶液具有强氧化性会腐蚀碱式滴定管的橡胶管不能装在碱式滴定管中,滴定时,用酸式滴定管盛装KMnO4溶液;②根据反应5Fe2++ MnO4-+8H+= 5Fe3++Mn2++4H2O可知,样品中Fe2+的质量分数为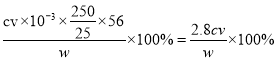 。
。


科目:高中化学 来源: 题型:
【题目】己知NA为阿伏加德罗常数的数值,下列说法正确的是
A. 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
B. 一定条件下在密闭容器中2 molSO2与2 molO2充分反应,最终的气体分子数为3NA
C. 将lmolNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
D. 4.6g乙醇含有共价键的数目为0.9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃0. 1mol 跟 0..2mol 氯化氢加成,其加成产物又可被0. 8mol 氯气完全取代, 该烃可能是( )
A. 丙烯 B. 1﹣丁烯 C. 丙炔 D. 2﹣丁炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。现利用下图所示装置进行实验。
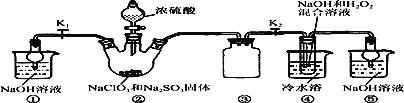
(1)装置③的作用是__________________________。
(2)装置②中产生ClO2的化学方程式为_______________________________________;装置④中制备NaClO2的离子方程式为____________________________________________。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55 ℃蒸发结晶;② 趁热过滤;③________________;④ 低于60 ℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO![]() +4I-+4H+===2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O
+4I-+4H+===2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() )。
)。
(4)配制待测液时,除用到烧杯、玻璃棒外,还必须用到的玻璃仪器有_________。
(5)该样品中NaClO2的质量分数为__________________(用含m、c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的性质与用途有关联的是
选项 | 性质 | 用途 |
A | H2能在O2中燃烧并放出大量的热 | H2用作洁净燃料 |
B | 硝酸能与苯发生取代反应 | 苯用作溶剂 |
C | 葡萄糖能与新制Cu(OH)2悬浊液反应 | 葡萄糖可用作甜味剂 |
D | 乙酸能与NaOH溶液反应 | 乙酸可用作调味剂 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g) ![]() 2CO2(g)+S(l)△H<0若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
2CO2(g)+S(l)△H<0若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俄罗斯科学家在利用回旋加速器进行的实验中,用含20个质子的钙元素的同位素反复轰击含95个质子的镅元素,结果成功制得4个第115号元素的原子。其与N元素同主族.这4个原子在生成数微秒后衰变成第113号元素.前者的一种核素为![]() 。下列有关叙述正确的是( )
。下列有关叙述正确的是( )
A. 115号元素衰变成113号元素是化学变化
B. 115号元素X的近似相对原子质量为288
C. 113号元素的原子最外层有3个电子
D. 因115号元素与N元素同主族,所以是非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnCO3可用于制备活性电极材料MnO2。以菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料制备碳酸锰粗产品的流程如下:
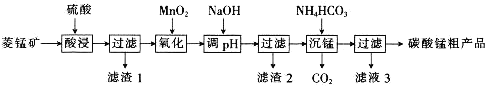
已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=4.0×10-34。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
(1)“酸浸”过程中不能用浓盐酸替代硫酸,原因是_________________________________。
(2)用离子方程式表示“氧化”过程中加MnO2的目的:______________________________。
(3)“调pH”时,向含有硫酸铁和硫酸铝的混合溶液中滴加氢氧化钠溶液至两种沉淀共存,当c(Fe3+)=1.0×10-5mol·L-1时,c(Al3+)=______________mol·L-1。
(4)①“沉锰”过程中,反应的离子方程式为__________________________________。
②“沉锰”过程中沉锰速率与温度的关系如图所示。
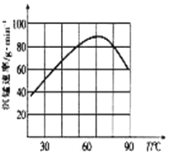
当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是___________________。
(5)从滤液3中可分离出一种不含碳元素的氮肥,它的化学式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com