
【题目】下列各组成分完全相同的是( )
A.液氯和氯气B.液氯和氯水C.液态氯化氢和盐酸D.水煤气和天然气
科目:高中化学 来源: 题型:
【题目】联合国气候变化大会于2009年12月7~18日在哥本哈根召开.中国政府承诺到2020年,单位GDP二氧化碳排放比2005年下降40%~45%. 电解
(1)有效“减碳”的手段之一是节能.下列制氢方法最符合的是(填字母序号).
A.电解水制氢:2H2O= ![]() 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O= ![]() 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O ![]() CO+3H2
CO+3H2
(2)用CO2和氢气合成CH3OCH3(甲 醚 )是解决能源危机的研究方向之一. 已知:
CO(g)+2H2(g)═CH3OH(g)△H=Q1 kJmol﹣1
2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=Q2 kJmol﹣1
CO(g)+H2O(g)═CO2(g)+H2(g)△H=Q3 kJmol﹣1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为 .
(3)在催化剂和一定温度、压强条件下,CO与H2可反应生成甲醇:CO(g)+2H2(g)CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:p1p2 (填“>”、“<”或“=”),上述反应的△H0 (填“<”、“>”或“=”) 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是( ) 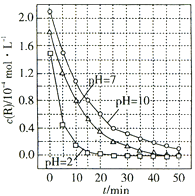
A.50min时,pH=2和pH=7时R的降解百分率相等
B.溶液酸性越强,R的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在20~25min之间,pH=10时R的平均降解速率为0.04 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)26H2O]又名摩尔盐,是浅绿色晶体,易溶于水,是分析化学中的重要试剂。某化学兴趣小组对摩尔盐的一些性质进行探究。回答下列问题:
(1)在试管中加入少量摩尔盐晶体,加水溶解,测得水溶液呈酸性。由此可知________。
(2)摩尔盐在500℃时隔绝空气加热完全分解,气体产物可能有NH3、SO2、SO3、H2O等。兴趣小组利用下图装置证明摩尔盐分解的气体产物中有SO2和SO3。

①a的名称是________。装置B的作用________。
②装置连接顺序为A→____→____→____→____(填字母序号)。
③能证明分解产物中有SO2的实验现象是________,反应的离子方程式是________。
④若装置连接顺序不变,能否将装置E中溶液换为BaCl2溶液?理由是________。
(3)为判断摩尔盐是否变质,可以测定样品中Fe2+的含量。取w g样品溶于水,配制成250 mL溶液。每次取25.00 mL溶液,用c mol/L的酸性KMnO4溶液滴定,滴定三次,平均消耗KMnO4溶液体积 v mL。
①滴定时,用________(填“酸式”或“碱式”)滴定管盛装KMnO4溶液。
②样品中Fe2+的质量分数为________(用含w、c、v的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)![]() CH3OH(g)H =a kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
CH3OH(g)H =a kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:

(1)能判断反应达到化学平衡状态的是 (填字母)。
A.c(CO)与c(H2)的比值保持不变
B.容器中气体压强保持不变
C.容器中气体密度保持不变
D.单位时间内有1molCO消耗的同时有1mol CH3OH生成
E.v正(H2)=2 v逆(CH3OH)
(2)①Ⅱ和Ⅰ相比,Ⅱ改变的反应条件是 。
②反应Ⅲ在9min时达到平衡,比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1 T3(填“>”“<”“=”),此正反应是________反应(填“放热或吸热”)。
(3)①反应Ⅰ在6 min时达到平衡,从反应开始到达到平衡时v (CH3OH) = mol/(L·min)。
②反应Ⅱ在2 min时达到平衡,计算该温度下的平衡常数K= 。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1 mol CO和3 mol CH3OH后,平衡将向_________(填“正反应、逆反应和不移动”),原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是一种重要的化工原料,可生产汽油、煤油、乙烯、苯等,实现石油的 综合利用,减少环境污染,是人类面临的重大课题.
(1)将石油分馏获得汽油、煤油等轻质油,是利用了各组分的_________不同;将 重油裂解可以获得很多化工原料,如 C8C18![]() C4H10+_____;
C4H10+_____;
(2)乙烯可制取聚乙烯塑料,聚乙烯的结构简式是______ ,它属于高分子 材料,大量使用塑料容易造成的环境问题是_______;
(3汽车尾气中的 NO 是雾霾成因之一,治理它的一种方法是在 400℃、催化剂存在的条件下使 NO 与 NH3 反应生成对大气无污染的物质,反应的化学方程式是__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氨基苯酚(HOC6H4NH2)是一种重要的有机合成中间体,可用硝基苯(C6H5NO2)电解还原制备,装置如图所示。下列说法正确的是
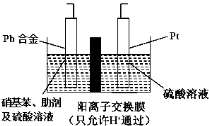
A.电解时Pt电极应与直流电源的负极相连
B.电解时Pt电极上有H2放出
C.阴极反式为:C6H5NO2+4e-+4H+===HOC6H4NH2+H2O
D.电解一段时间后,硫酸溶液的pH不变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子M2O7X-与S2-能在酸性溶液中发生如下反应:M2O7X-+3S2-+14H+=2M3+ +3S +7H2O,则M2O7X-中M的化合价为( )
A.+4B.+5C.+6D.+7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学小组制备硝基苯的实验装置如下,有关数据列如下表。已知存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯。

实验步骤如下:
取100mL烧杯,用20 mL浓硫酸与足量浓硝酸配制混和酸,将混合酸小心加入B中。把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀。在50~60℃下发生反应,直至反应结束。
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210℃馏分,得到纯硝基苯18g。
回答下列问题:
(1)图中装置C的作用是____________________。
(2)制备硝基苯的化学方程式_____________________。
(3)配制混合酸时,能否将浓硝酸加入到浓硫酸中_________(“是”或“否”),说明理由:____________________。
(4)为了使反应在50℃~60℃下进行,常用的方法是______________。反应结束并冷却至室温后A中液体就是粗硝基苯,粗硝基苯呈黄色的原因是_____________________。
(5)在洗涤操作中,第二次水洗的作用是_____________________。
(6)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用水直形冷凝管的原因是_______________________。
(7)本实验所得到的硝基苯产率是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com