
【题目】某科学小组制备硝基苯的实验装置如下,有关数据列如下表。已知存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯。

实验步骤如下:
取100mL烧杯,用20 mL浓硫酸与足量浓硝酸配制混和酸,将混合酸小心加入B中。把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀。在50~60℃下发生反应,直至反应结束。
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210℃馏分,得到纯硝基苯18g。
回答下列问题:
(1)图中装置C的作用是____________________。
(2)制备硝基苯的化学方程式_____________________。
(3)配制混合酸时,能否将浓硝酸加入到浓硫酸中_________(“是”或“否”),说明理由:____________________。
(4)为了使反应在50℃~60℃下进行,常用的方法是______________。反应结束并冷却至室温后A中液体就是粗硝基苯,粗硝基苯呈黄色的原因是_____________________。
(5)在洗涤操作中,第二次水洗的作用是_____________________。
(6)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用水直形冷凝管的原因是_______________________。
(7)本实验所得到的硝基苯产率是_____________________。
【答案】 冷凝回流 ![]() 否 液体容易迸溅 水浴加热 溶有浓硝酸分解产生的NO2 洗去残留的NaOH及生成的钠盐 防止直形冷凝管通水冷却导致玻璃温差大而炸裂 72%
否 液体容易迸溅 水浴加热 溶有浓硝酸分解产生的NO2 洗去残留的NaOH及生成的钠盐 防止直形冷凝管通水冷却导致玻璃温差大而炸裂 72%
【解析】根据题意浓硫酸、浓硝酸和苯在加热时反应生成硝基苯,反应后,将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤,先用水洗除去浓硫酸、硝酸,再用氢氧化钠除去溶解的少量酸,最后水洗除去未反应的NaOH及生成的盐;分出的产物加入无水CaCl2颗粒,吸收其中少量的水,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210℃馏分,得到纯硝基苯;计算产率时,根据苯的质量计算硝基苯的理论产量,产率=![]() ×100%。
×100%。
(1)装置C为冷凝管,作用是导气、冷凝回流,可以冷凝回流挥发的浓硝酸以及苯使之充分反应,减少反应物的损失,提高转化率,故答案为:冷凝回流;
(2)根据题意,浓硫酸、浓硝酸和苯在加热时反应生成硝基苯,制备硝基苯的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)浓硫酸密度大于浓硝酸,应将浓硝酸倒入烧杯中,浓硫酸沿着烧杯内壁缓缓注入,并不断搅拌,如果将浓硝酸加到浓硫酸中可能发生液体飞溅,故答案为:否;液体容易迸溅浓硝酸;
(4)为了使反应在50℃~60℃下进行,可以用水浴加热的方法控制温度。反应结束并冷却至室温后A中液体就是粗硝基苯,由于粗硝基苯中溶有浓硝酸分解产生的NO2,使得粗硝基苯呈黄色,故答案为:水浴加热;溶有浓硝酸分解产生的NO2;
(5)先用水洗除去浓硫酸、硝酸,再用氢氧化钠除去溶解的少量酸,最后水洗除去未反应的NaOH及生成的盐,故答案为:洗去残留的NaOH及生成的钠盐;
(6)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用水直形冷凝管是为了防止直形冷凝管通水冷却导致玻璃温差大而炸裂,故答案为:防止直形冷凝管通水冷却导致玻璃温差大而炸裂;
(7)苯完全反应生成硝基苯的理论产量为15.84g×![]() ,故硝基苯的产率为[18g÷(15.84g×
,故硝基苯的产率为[18g÷(15.84g×![]() )]×100%=72%,故答案为:72%。
)]×100%=72%,故答案为:72%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】高分子化合物M 和N 是生产生活中有广泛用途的有机高分子材料。以芳香化合物E和链烃A为基本原料合成M 和N 的线路如下:

已知:①A的密度是相同条件下H2密度的20倍;
②羧基能被LiAlH4还原为羟基
③![]() (R 表示烃基)
(R 表示烃基)
④ (R1、R2、R3表示烃基)
(R1、R2、R3表示烃基)
请回答下列问题:
(1)E的化学名称为________________,A 的结构简式为___________________________。
(2)D中官能团的名称________________________________。
(3)F→G的反应类型__________________________。
(4)D+J→K的化学反应方程式为_______________________________。
(5)I+J→N的化学反应方程式为________________________________________。
(6)与F互为同分异构体,且含有一个六元环且环上有3个取代基的结构有_________种(含F),任写一种核磁共振氢谱有4组峰的结构简式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnCO3可用于制备活性电极材料MnO2。以菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料制备碳酸锰粗产品的流程如下:
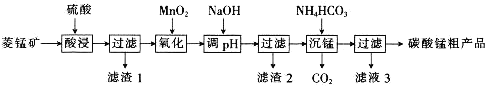
已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=4.0×10-34。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
(1)“酸浸”过程中不能用浓盐酸替代硫酸,原因是_________________________________。
(2)用离子方程式表示“氧化”过程中加MnO2的目的:______________________________。
(3)“调pH”时,向含有硫酸铁和硫酸铝的混合溶液中滴加氢氧化钠溶液至两种沉淀共存,当c(Fe3+)=1.0×10-5mol·L-1时,c(Al3+)=______________mol·L-1。
(4)①“沉锰”过程中,反应的离子方程式为__________________________________。
②“沉锰”过程中沉锰速率与温度的关系如图所示。
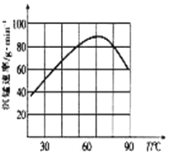
当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是___________________。
(5)从滤液3中可分离出一种不含碳元素的氮肥,它的化学式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】19.己烯雌酚(结构简式如下图所示),是一种激素类药物。下列叙述不正确的是( )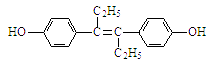
A.己烯雌酚的分子式为C18H20O2
B.己烯雌酚与NaOH溶液、NaHCO3溶液均能反应
C.1 mol己烯雌酚最多能与2mol Na发生反应
D.己烯雌酚与饱和溴水可以发生加成反应和取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是周期表短周期的一部分,A、B、C三种元素的原子核外电子数之和等于B的质量数,B元素的原子核内质子数等于中子数。下列叙述正确的是 ( )
![]()
A. A、B、C离子半径大小:A>C>B
B. C元素单质是氧化性最强的非金属单质
C. A与C的气态氢化物饱和水溶液的pH:A<C
D. 最高价氧化物对应水化物的酸性:C>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时还能制得氢气,具体流程如下:

下列说法正确的是
A. 分离器中的物质分离操作为过滤
B. 膜反应器中,增大压强有利于提高HI的分解速率和平衡转化率
C. 该工艺中I2和HI的相互转化体现了“碘循环”
D. 碘循环工艺的总反应为2SO2+4H2O+I2 == H2+2H2SO4+ 2HI
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com