
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时还能制得氢气,具体流程如下:

下列说法正确的是
A. 分离器中的物质分离操作为过滤
B. 膜反应器中,增大压强有利于提高HI的分解速率和平衡转化率
C. 该工艺中I2和HI的相互转化体现了“碘循环”
D. 碘循环工艺的总反应为2SO2+4H2O+I2 == H2+2H2SO4+ 2HI
科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)qC(g)△H在密闭容器中进行.如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况.下列推断中正确的是( )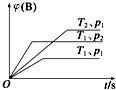
A.p1>p2 , T1<T2 , m+n>q,△H<0
B.p1<p2 , T1>T2 , m+n>q,△H<0
C.p1>p2 , T1<T2 , m+n<q,△H<0
D.p1<p2 , T1>T2 , m+n<q,△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)粗制CuSO45H2O晶体中常含有杂质Fe2+ . ①在提纯时为了除去Fe2+ , 常加入合适氧化剂,使Fe2+氧化为Fe3+ , 下列物质最好选用的是 .
A.氯水 B.HNO3 C.KMnO4 D.H2O2
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3 , 调整溶液pH可选用下列中的 .
A.CuOB.Cu(OH)2 C.NaOH D.NH3H2O
(2)在25℃下,向浓度均为0.1molL﹣1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为 . 已知25℃时Ksp[Mg(OH)2]=1.8×10﹣11 , Ksp[Cu(OH)2]=2.2×10﹣20 .
(3)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, ![]() = . [Ksp(AgBr)=5.4×10﹣13 , Ksp(AgCl)=2.0×10﹣10].
= . [Ksp(AgBr)=5.4×10﹣13 , Ksp(AgCl)=2.0×10﹣10].
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.A、B、C、D均为中学化学常见的纯净物,A是单质,它们之间有如下的反应关系;
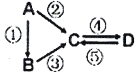
(1)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染,B与C在一定条件下反应生成的A是大气的主要成分,写出B-C的化学方程式:_______________。
(2)若D物质具有两性,②、③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体,写出A→C的离子方程式:______________________。
(3)若A是制作芯片常用材料,B为A单质的氧化物,C为水玻璃的主要成分.写出A→C的离子方程式:__________________________。
(4)若A是应用最广泛的金属.④反应用到A,②、⑤反应均用到同一种非金属单质,C的溶液用于蚀刻印刷铜电路板,写出C→D的离子方程式:__________________。
(5)若A为淡黄色固体,C、D是氧化物,且是是造成酸雨的主要物质,B与C可反应生成A。写出B完全燃烧的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊在元素周期表中的相对位置如表所示,其中丁所处的主族序数是其周期序数的三倍。回答下列问题:
乙 | 丙 | 丁 | |
甲 | 戊 |
(1)乙在元素周期表中的位置是___________________。
(2)原子半径:戊______甲(填“>”或“<”)。
(3)乙与戊组成化合物的电子式为______,其中化学键的类型是_____(填“极性”或“非极性”)共价键。
(4)元素的非金属性:甲______丙(填“>”或“<”),下列事实能说明该结论的是_______(填字母)。
A.丙的氢化物稳定,甲的氢化物不稳定
B.丙的最高价氧化物对应的水化物是强酸,甲的是弱酸
C.丙的最高价氧化物对应的水化物易溶于水,甲的难溶
(5)工业上制取甲(粗品)的化学方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度(×10﹣3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①可以判断该分解反应已经达到化学平衡的是(填字母).
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0℃时的分解平衡常数为 .
(2)已知:NH2COONH4+2H2ONH4HCO3+NH3H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO﹣)随时间变化趋势如图所示.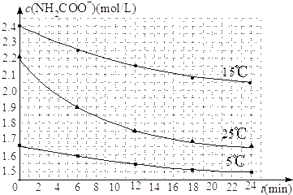
③计算25℃时,0~6min氨基甲酸铵水解反应的平均速率为 .
④根据图中信息,如何说明水解反应的平均速率随温度升高而增大: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com