
【题目】根据所学知识完成题目:
(1)粗制CuSO45H2O晶体中常含有杂质Fe2+ . ①在提纯时为了除去Fe2+ , 常加入合适氧化剂,使Fe2+氧化为Fe3+ , 下列物质最好选用的是 .
A.氯水 B.HNO3 C.KMnO4 D.H2O2
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3 , 调整溶液pH可选用下列中的 .
A.CuOB.Cu(OH)2 C.NaOH D.NH3H2O
(2)在25℃下,向浓度均为0.1molL﹣1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为 . 已知25℃时Ksp[Mg(OH)2]=1.8×10﹣11 , Ksp[Cu(OH)2]=2.2×10﹣20 .
(3)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, ![]() = . [Ksp(AgBr)=5.4×10﹣13 , Ksp(AgCl)=2.0×10﹣10].
= . [Ksp(AgBr)=5.4×10﹣13 , Ksp(AgCl)=2.0×10﹣10].
【答案】
(1)D;AB
(2)Cu(OH)2;Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+
(3)2.7×10﹣3
【解析】解:(1)①氧化剂使Fe2+氧化为Fe3+ , 不能引入新杂质,只有过氧化氢符合,所以答案是:D;②调整溶液至pH=4,使Fe3+转化为Fe(OH)3 , 可加不溶于水的物质促进铁离子的水解,且不引入新杂质,而C、D均与金属阳离子反应,所以答案是:AB;(2)难溶电解质的溶度积越小,加入氨水时越易生成沉淀,则生成的沉淀为Cu(OH)2 , 反应的离子方程式为Cu2++2NH3H2O=Cu(OH)2↓+2NH4+ , 所以答案是:Cu(OH)2;Cu2++2NH3H2O=Cu(OH)2↓+2NH4+;(3)当两种沉淀共存时,溶液是AgCl和AgBr的饱和溶液,溶液中 ![]() =
= ![]() =
= ![]() =2.7×10﹣3 , 所以答案是:2.7×10﹣3 .
=2.7×10﹣3 , 所以答案是:2.7×10﹣3 .


科目:高中化学 来源: 题型:
【题目】A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
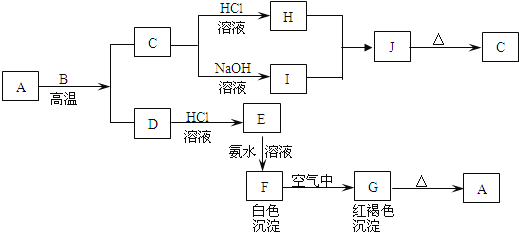
(1)写出下列物质的化学式:A:________,E:________,J:________,G:________.
(2)按要求写方程式:
①A与B在高温条件下生成C和D的化学方程式:________________________________;
②C转化为I的离子方程式:___________________________________________.
③F在空气中转化为G的化学方程式:__________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
C(s)+O2(g)=CO2(B) △H=-393.5kJ/mol
2C(g)+O2(g)=2CO(g) △H=-221kJ/mol
则:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H=_______。
(2)在密闭容器中充入5molCO和4molNO,发生上述(1)中某反应,如图为平衡时NO的体积分数与温度、压强的关系。回答下列问题:
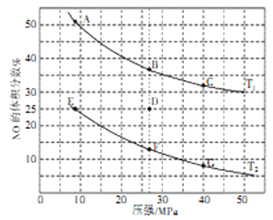
①温度:T1_____T2(填“<”或“>”)。
②某温度下,若反应进行到10分钟达到平衡状态D点时,容器的体积为2L,则此时的平衡常数K=______(保留小数点后两位)。用CO的浓度变化表示起始到平衡的平均反应速率V(CO)=_____。
(3)氮的另一种化合物N2H4(肼)可作制药的原料,也可作火箭的燃料。
①肼的电子式为__________。
②肼能与酸反应。N2H6Cl2溶液呈弱酸性,在水中存在如下反应:
N2H62++H2O=N2H5++H3O+平衡常数K1
N2H5++H2O=N2H4+H3O+平衡常数K2
相同温度下,K1>K2,其主要原因有两个:
a.电荷因素,N2H5+水解程度小于N2H62+;
b.__________________。
(4)肼还可以制备肼一碱性燃料电池,氧化产物为稳定的对环境友好的物质。该电池负极的电极反应式为____________。若以肼一氧气碱性燃料电池为电源,以NiSO4溶液为电镀液,在金属器具上镀镍,开始两极质量相等,当两极质量之差为1.174g时,燃料电池中内电路至少有_______molOH-迁移通过阴离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。电解质溶液为KOH溶液,电池反应为:Cd +2NiO(OH)+2H2O![]() Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是:( )
Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是:( )
A. 放电时电池内部OH-向正极移动
B. 放电时正极附近溶液的pH减小
C. 充电时阳极反应为Cd(OH)2+2e -= Cd + 2OH-
D. 充电时与直流电源正极相连的电极上发生Ni(OH)2转化为NiO(OH)的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时还能制得氢气,具体流程如下:

下列说法正确的是
A. 分离器中的物质分离操作为过滤
B. 膜反应器中,增大压强有利于提高HI的分解速率和平衡转化率
C. 该工艺中I2和HI的相互转化体现了“碘循环”
D. 碘循环工艺的总反应为2SO2+4H2O+I2 == H2+2H2SO4+ 2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,它们原子的核电荷数均小于18,且依次增大,A原子核内仅有一个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子最外层电子数之和与C原子的最外层电子数相等;D原子有两个电子层,最外层龟子数是次外层电子数的3倍。
(1)试推断它们各是什么元素? 写出它们的元素符号:A______,B________,C_______,D_______。
(2)甲、乙、丙、丁是由以上四种元素中的几种组成的10 电子微粒;
①甲为分子,且能刻蚀玻璃,则甲的化学式为______
②乙为气体,且遇到无色酚酞溶液变成红色,则乙的化学式为_______
③丙为阳离子,丁为阴离子,且丙和丁在加热条件下生成的两种物质也是10电子微粒,请写出该反应的离子方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(NH2COONH4)是重要的氨化剂,在潮湿的空气中能转化为碳酸铵,受热易分解、易被氧化。实验小组对氨基甲酸铵的性质进行了如下探究。请回答下列问题:
(1)氨基甲酸铵在潮湿的空气中转化为碳酸铵的化学方程式为____________________________。
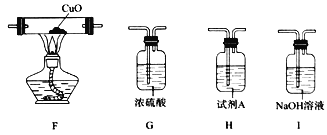
(2)用下图装置探究氨基甲酸铵的分解产物(夹持装置略去,下同)。

①点燃A处的酒精灯之前,需先打开k,向装置中通入一段时间的N2,目的为_________________。
②仪器B的名称为_________________。
③装置D的作用为________________________________________________________。
④能证明分解产物中有NH3的现象为_________________________________________。
⑤试剂A用于检验分解产物中的CO2,该试剂的名称为_______________________。
(3)已知:CuO高温能分解为Cu2O和O2。若用上述装置和下列部分装置进一步检验分解产物中是否有CO,装置E后应依次连接_________________(按从左到右的连接顺序填选项字母)。
(4)通过实验得出结论:氨基甲酸铵受热分解为NH3和CO2。该反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,2L物质的量浓度为0.5molL﹣1KOH溶液含有( )
A.0.5mol的K+
B.0.5mol的H+
C.1.0mol的H+
D.1.0mol的OH﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com