
����Ŀ�����ٵ����������̼���������ڴ����е��ŷ��ǻ�����������Ҫ����֮һ��
��1����֪:N2(g)+O2(g)=2NO(g) ��H=+180.5kJ/mol
C(s)+O2(g)=CO2(B) ��H=-393.5kJ/mol
2C(g)+O2(g)=2CO(g) ��H=-221kJ/mol
��:2NO(g)+2CO(g)=N2(g)+2CO2(g) ��H=_______��
��2�����ܱ������г���5molCO��4molNO������������1����ij��Ӧ����ͼΪƽ��ʱNO������������¶ȡ�ѹǿ�Ĺ�ϵ���ش���������:
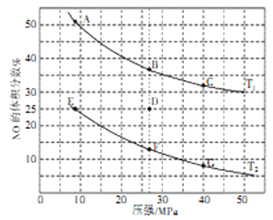
���¶�:T1_____T2������<������>������
��ij�¶���,����Ӧ���е�10���Ӵﵽƽ��״̬D��ʱ,���������Ϊ2L�����ʱ��ƽ�ⳣ��K=______������С�������λ������CO��Ũ�ȱ仯��ʾ��ʼ��ƽ���ƽ����Ӧ����V(CO)=_____��
��3��������һ�ֻ�����N2H4������������ҩ��ԭ�ϣ�Ҳ���������ȼ�ϡ�
���µĵ���ʽΪ__________��
���������ᷴӦ��N2H6Cl2��Һ�������ԣ���ˮ�д������·�Ӧ:
N2H62++H2O=N2H5++H3O+ƽ�ⳣ��K1
N2H5++H2O=N2H4+H3O+ƽ�ⳣ��K2
��ͬ�¶��£�K1>K2������Ҫԭ��������:
a.������أ�N2H5+ˮ��̶�С��N2H62+��
b.__________________��
��4���»������Ʊ���һ����ȼ�ϵ��,��������Ϊ�ȶ��ĶԻ����Ѻõ����ʡ��õ�ظ����ĵ缫��ӦʽΪ____________��������һ��������ȼ�ϵ��Ϊ��Դ����NiSO4��ҺΪ���Һ���ڽ��������϶���,��ʼ����������ȣ�����������֮��Ϊ1.174gʱ��ȼ�ϵ�����ڵ�·������_______molOH-Ǩ��ͨ�������ӽ���Ĥ��
���𰸡� -746.5kJ/mol > 0.22 0.1 mol/��Lmin�� �� ��һ��ˮ������H3O+�Եڶ���ˮ������������ N2H4-4e-+4OH-=N2��+4H2O 0.02
�������������������1�����ݸ�˹���ɼ���2NO(g)+2CO(g)=N2(g)+2CO2(g) ���ʱ���
��2����2NO(g)+2CO(g)=N2(g)+2CO2(g) ��H=-746.5kJ/mol������Ӧ���ȣ������¶�ƽ�������ƶ���NO��������������� �����á�����ʽ������ƽ�ⳣ��������![]() �������ʣ���3���� �·����к���1��N-N ������4��N-H�������ڵ�һ��ˮ������H3O+�Եڶ���ˮ����������������4������������Ӧ�����ȶ��ĶԻ����Ѻõ����ʵ������·���������Ӧ�����Ը�����Ӧ����ʧ�������ɵ�����ˮ���ڽ��������϶���,��ʼ����������ȣ�����������֮��Ϊ1.174gʱ�������ܽ���������Ϊ0.587g�����ݵ���غ����ת��OH-�����ʵ�����
�������ʣ���3���� �·����к���1��N-N ������4��N-H�������ڵ�һ��ˮ������H3O+�Եڶ���ˮ����������������4������������Ӧ�����ȶ��ĶԻ����Ѻõ����ʵ������·���������Ӧ�����Ը�����Ӧ����ʧ�������ɵ�����ˮ���ڽ��������϶���,��ʼ����������ȣ�����������֮��Ϊ1.174gʱ�������ܽ���������Ϊ0.587g�����ݵ���غ����ת��OH-�����ʵ�����
��������1����N2(g)+O2(g)=2NO(g) ��H=+180.5kJ/mol
��C(s)+O2(g)=CO2(B) ��H=-393.5kJ/mol
��2C(g)+O2(g)=2CO(g) ��H=-221kJ/mol
���ݸ�˹�����ڡ�2���٣��۵�:2NO(g)+2CO(g)=N2(g)+2CO2(g) ��H=-746.5kJ/mol��
��2����2NO(g)+2CO(g)=N2(g)+2CO2(g) ��H=-746.5kJ/mol������Ӧ���ȣ������¶�ƽ�������ƶ���NO�������������������T1>T2��
��D��NO���������Ϊ25%��
![]() ��
��
���x=0.5 ��  ������
������![]() , V(CO)=
, V(CO)= ![]() 0.1 mol/��Lmin�� ��
0.1 mol/��Lmin�� ��
��3���� �·����к���1��N-N ������4��N-H�������µĵ���ʽ��![]() ����N2H62+��һ��ˮ������H3O+�Եڶ���ˮ�����������ã�������ͬ�¶��£�K1>K2����4������������Ӧ�����ȶ��ĶԻ����Ѻõ����ʵ������·���������Ӧ�����Ը�����Ӧ����ʧ�������ɵ�����ˮ��������ӦΪN2H4-4e-+4OH-=N2��+4H2O���ڽ��������϶���,��ʼ����������ȣ�����������֮��Ϊ1.174gʱ�������ܽ���������Ϊ0.587g����·��ת�Ƶ���
����N2H62+��һ��ˮ������H3O+�Եڶ���ˮ�����������ã�������ͬ�¶��£�K1>K2����4������������Ӧ�����ȶ��ĶԻ����Ѻõ����ʵ������·���������Ӧ�����Ը�����Ӧ����ʧ�������ɵ�����ˮ��������ӦΪN2H4-4e-+4OH-=N2��+4H2O���ڽ��������϶���,��ʼ����������ȣ�����������֮��Ϊ1.174gʱ�������ܽ���������Ϊ0.587g����·��ת�Ƶ���![]() �����ݵ���غ���ת��OH-�����ʵ���Ϊ0.02mol��
�����ݵ���غ���ת��OH-�����ʵ���Ϊ0.02mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵؿ��к�����Ϊ�ḻ�ķǽ���Ԫ�أ����ĵ��ʺͻ������ڹ�ũҵ������Ӧ�ù㷺������ͨ����Ӧ 2Ca3(PO4)2+10C��6CaO+P4+10CO ��á����������գ�
��1����ԭ�ӵ����������Ų�ʽ��__________����ԭ�Ӻ�����______�ֲ�ͬ�˶�״̬�ĵ��ӡ�C��O����Ԫ�طǽ����Խ�ǿ����_______________��
��2�������ڿ�����¶��ʱ�䳤�˻����¶ȴﵽ____����ȼ��ʹ�������µ�������Ҫ����_________��ij�¶�ʱ����2.0L�����ܱ������г���0.5mol PCl5��������ӦPCl5(g)![]() PCl3(g)+Cl2(g)��Q������һ��ʱ���ﵽƽ�⡣
PCl3(g)+Cl2(g)��Q������һ��ʱ���ﵽƽ�⡣
��3���÷�Ӧ��ƽ�ⳣ������ʽ K=_____________��
��4�������������䣬��ʼʱ�����������г���1.0 mol PCl5���ﵽƽ��ʱ��PCl5��ת����____��ѡ������������ ����С��������������ƽ�ⳣ�� K____��ѡ������������ ����С��������������
��5���ڲ�ͬʱ�䣨t����÷�Ӧ������ PCl5 �IJ����������£�
t��s�� | 0 | 50 | 100 | 250 | 350 |
n��mol�� | 0.5 | 0.42 | 0.41 | 0.40 | 0.40 |
�� 100s ʱ�� PCl3�����ʵ���Ũ����__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A��AlCl3��Һ��ͨ������İ�ˮ��Al3++4NH3��H2O��AlO2��+2H2O+4NH4+
B����NH4 HCO3��Һ�мӹ���NaOH ��Һ�����ȣ�NH4����OH��![]() NH3����H2O
NH3����H2O
C����CuƬ����ϡ�����У�3Cu+8H++2NO3�� ��3Cu2++2NO��+4H2O
D����Na2S2O3��Һ�м���ϡ������2S2O32��+2H+��SO42��+3S��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴ӦA��g��+2B��g��2C��g��������Ӧ���ȣ�������ͼ����ȷ���ǣ� ��
A.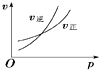
B.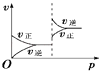
C.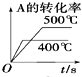
D.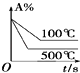
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���̼��(H2C2O4��HC2O4-��C2O42-)������0.1mol/L������Һ���Ũ��NaOH��Һ��Ӧ�����Һ�У����ǵ����ʵ���������(ij�����ʵ���Ũ�������������ʵ���Ũ�Ⱥͱ�ֵ)����ҺpH�Ĺ�ϵ��ͼ��ʾ�������й�˵���������
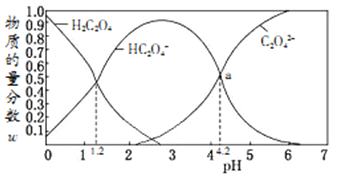
A. ��pH=1.2����Һ�м�NaOH��Һ��pH������4.2�Ĺ�����ˮ�ĵ����һֱ����
B. pH=4.2ʱ����Һ��c(Na+)>c(HC2O4-)+c(C2O42-)
C. ������ĵڶ�������ƽ�ⳣ��ΪK2����lgK2=-4.2
D. ��0.1mol/L��ͬ���ʵ���Ũ��NaHC2O4��Na2C2O4��������Һ�������ϣ��������ͼa����ʾ���Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У��������л������(����)
A.���Ȼ�̼B.���軯��C.����D.�ƾ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ��Һ���ܹ�����������ǣ�������
A.Na+��Cl����NO3��
B.Ag+��Cl����NO3��
C.NH4+��OH����SO42��
D.Na+��Fe2+��OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ�����Ŀ��
��1������CuSO45H2O�����г���������Fe2+ �� �����ᴿʱΪ�˳�ȥFe2+ �� �����������������ʹFe2+����ΪFe3+ �� �����������ѡ�õ��� ��
A����ˮ�� ��B��HNO3���� C��KMnO4�� ��D��H2O2
��Ȼ���ټ����ʵ����ʵ�����Һ��pH=4��ʹFe3+ת��ΪFe��OH��3 �� ������ҺpH��ѡ�������е� ��
A��CuOB��Cu��OH��2 C��NaOH D��NH3H2O
��2����25���£���Ũ�Ⱦ�Ϊ0.1molL��1��MgCl2��CuCl2�����Һ����μ��백ˮ���������������ѧʽ�������ɸó��������ӷ���ʽΪ �� ��֪25��ʱKsp[Mg��OH��2]=1.8��10��11 �� Ksp[Cu��OH��2]=2.2��10��20 ��
��3����BaCl2��Һ�м���AgNO3��KBr�������ֳ�������ʱ�� ![]() = �� [Ksp��AgBr��=5.4��10��13 �� Ksp��AgCl��=2.0��10��10]��
= �� [Ksp��AgBr��=5.4��10��13 �� Ksp��AgCl��=2.0��10��10]��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ռ�ʵ���ҡ��칬һ�š��Ĺ���ϵͳ������������ȼ�ϵ�أ�RFC����RFC��һ�ֽ�ˮ��⼼��������ȼ�ϵ�ؼ������ϵĿɳ���أ���ͼΪRFC����ԭ��ʾ��ͼ���й�˵����ȷ���ǣ� �� 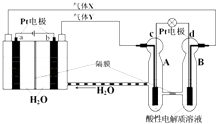
A.ת��0.1mol����ʱ��a�缫����1.12LH2
B.b�缫�Ϸ�����ԭ��Ӧ
C.���Ե������Һ��H+����c�缫
D.d�缫�Ϸ����ĵ缫��Ӧ�ǣ�O2+4H++4e��=2H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com