
【题目】高分子化合物M 和N 是生产生活中有广泛用途的有机高分子材料。以芳香化合物E和链烃A为基本原料合成M 和N 的线路如下:

已知:①A的密度是相同条件下H2密度的20倍;
②羧基能被LiAlH4还原为羟基
③![]() (R 表示烃基)
(R 表示烃基)
④ (R1、R2、R3表示烃基)
(R1、R2、R3表示烃基)
请回答下列问题:
(1)E的化学名称为________________,A 的结构简式为___________________________。
(2)D中官能团的名称________________________________。
(3)F→G的反应类型__________________________。
(4)D+J→K的化学反应方程式为_______________________________。
(5)I+J→N的化学反应方程式为________________________________________。
(6)与F互为同分异构体,且含有一个六元环且环上有3个取代基的结构有_________种(含F),任写一种核磁共振氢谱有4组峰的结构简式_____________________________。
【答案】 2,4-二氯甲苯 CH=CCH3 碳碳双健、羧基 消去反应 
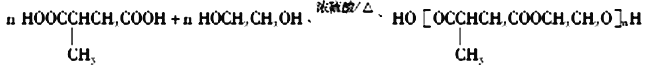 +(2n-1)H2O 12
+(2n-1)H2O 12 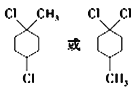
【解析】已知:①A的密度是相同条件下H2密度的20倍,所以A的分子量为40,根据CnH2n-2通式,可知14n-2=40, n=3, A的分子式为C3H4;丙炔与氯化氢加成生成CH2=CHCl-CH3(B), CH2=CHCl-CH3(B)与NaCN发生取代反应生成CH2=CHCN-CH3(C),CH2=CHCN-CH3发生水解生成![]() (D);有机物E与氢气发生加成反应生成氯代环烷烃F,然后氯代环烷烃F在氢氧化钠的醇溶液中加热发生消去反应生成环烯烃(G),根据信息④可知:环烯烃(G)在酸性高锰酸钾溶液的作用下,氧化为羧酸H(HO-CH2-COOH),根据信息②,HO-CH2-COOH还原为HO-CH2-CH2-OH (J); I为HOOCCH(CH3)CH2COOH;
(D);有机物E与氢气发生加成反应生成氯代环烷烃F,然后氯代环烷烃F在氢氧化钠的醇溶液中加热发生消去反应生成环烯烃(G),根据信息④可知:环烯烃(G)在酸性高锰酸钾溶液的作用下,氧化为羧酸H(HO-CH2-COOH),根据信息②,HO-CH2-COOH还原为HO-CH2-CH2-OH (J); I为HOOCCH(CH3)CH2COOH;
(1)根据E的结构简式可知,其化学名称为2,4-二氯甲苯;A的密度是相同条件下H2密度的20倍,所以A的分子量为40,根据CnH2n-2通式,可知14n-2=40, n=3, A的分子式为C3H4; A为丙炔,A的结构简式为CH≡CCH3;正确答案:2,4-二氯甲苯;CH≡CCH3。
(2)根据以上分析可知有机物D为HOOC-CH=CH-CH3,官能团的名称碳碳双健、羧基;正确答案:碳碳双健、羧基。
(3)根据反应条件可知,在氢氧化钠的醇溶液中加热发生的F→G的反应类型为消去反应;正确答案:消去反应。
4)根据以上分子可知: 有机物![]() 与有机物HO-CH2-CH2-OH发生酯化反应,化学反应方程式为:
与有机物HO-CH2-CH2-OH发生酯化反应,化学反应方程式为: ;正确答案:
;正确答案: 。
。
(5)根据以上分析可知:有机物I为HOOCCH(CH3)CH2COOH,有机物J为HO-CH2-CH2-OH,二者发生缩聚反应,化学反应方程式为 +(2n-1)H2O ;正确答案:
+(2n-1)H2O ;正确答案: +(2n-1)H2O 。
+(2n-1)H2O 。
(6)有机物F为的分子式为C7H12Cl2,含有一个六元环且环上有3个取代基,结构有:1个甲基和1个氯原子连在环己烷上的同一个碳上,另外1个氯原子连环上邻间对三个位置上,结构有3种;甲基连在环上1个碳上,两个氯原子连在环上同一个碳上的位置有邻间对三个位置上,结构有3种;甲基、两个氯原子分别连在环上的不同碳上,结构有6种;共计有12种;其中核磁共振氢谱有4组峰的结构简式有2种: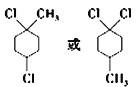 ;正确答案:12;
;正确答案:12; 。
。


科目:高中化学 来源: 题型:
【题目】一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是( ) 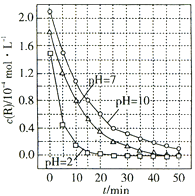
A.50min时,pH=2和pH=7时R的降解百分率相等
B.溶液酸性越强,R的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在20~25min之间,pH=10时R的平均降解速率为0.04 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氨基苯酚(HOC6H4NH2)是一种重要的有机合成中间体,可用硝基苯(C6H5NO2)电解还原制备,装置如图所示。下列说法正确的是
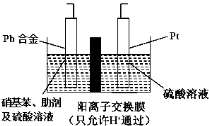
A.电解时Pt电极应与直流电源的负极相连
B.电解时Pt电极上有H2放出
C.阴极反式为:C6H5NO2+4e-+4H+===HOC6H4NH2+H2O
D.电解一段时间后,硫酸溶液的pH不变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子M2O7X-与S2-能在酸性溶液中发生如下反应:M2O7X-+3S2-+14H+=2M3+ +3S +7H2O,则M2O7X-中M的化合价为( )
A.+4B.+5C.+6D.+7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。

(1)加热前通入氮气的目的是_____________,操作方法为______________。
(2)装置A、C、D中盛放的试剂分别为A________,C________,D________。
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl的含量将_______(填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将________;若撤去E装置,则测得Na2CO3·10H2O的含量将________。
(4)若样品质量为wg,反应后C、D增加的质量分别为m1g、m2g,由此可知混合物中NaHCO3的质量分数为_______(用含w、m1、m2的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同周期。甲、乙、己是由这些元素组成的二元化合物。 0.001 molL-1 的己溶液pH为3;庚是具有漂白性的混合物。上述物质的转化关系如图所示。下列说法正确的是:( )

A. 原子半径Z>Y>X
B. 仅由这四种元素构成的溶液可能呈酸性、碱性或中性
C. 己为由极性键构成的非极性分子
D. 戊为一元弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/L的HCl溶液滴定10.00mL 0.1mol/LROH,其滴定曲线如图所示。 ,下列分析不正确的是
,下列分析不正确的是

A. ROH为弱碱
B. 若a=8,从A到B的过程中,水的电离程度逐渐减小
C. A点溶液c ( Cl-)=c (R+)
D. 若b=15,溶液中存在![]() c(Cl-)+c(ROH)+c(OH-)=c(H+)
c(Cl-)+c(ROH)+c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学小组制备硝基苯的实验装置如下,有关数据列如下表。已知存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯。

实验步骤如下:
取100mL烧杯,用20 mL浓硫酸与足量浓硝酸配制混和酸,将混合酸小心加入B中。把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀。在50~60℃下发生反应,直至反应结束。
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210℃馏分,得到纯硝基苯18g。
回答下列问题:
(1)图中装置C的作用是____________________。
(2)制备硝基苯的化学方程式_____________________。
(3)配制混合酸时,能否将浓硝酸加入到浓硫酸中_________(“是”或“否”),说明理由:____________________。
(4)为了使反应在50℃~60℃下进行,常用的方法是______________。反应结束并冷却至室温后A中液体就是粗硝基苯,粗硝基苯呈黄色的原因是_____________________。
(5)在洗涤操作中,第二次水洗的作用是_____________________。
(6)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用水直形冷凝管的原因是_______________________。
(7)本实验所得到的硝基苯产率是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.1gH2和4gO2反应放出71.45kJ热量,则氢气的燃烧热为142.9 kJmol﹣1
B.在稀溶液中,H+(aq)+OH﹣(aq)═H2O(1)△H=﹣57.3 kJmol﹣1,若将含0.5molH2SO4的浓硫酸与含1molNaOH的氢氧化钠溶液混合,放出的热量大于57.3kJ
C.HCl和NaOH反应的中和热△H=﹣57.3 kJmol﹣1,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJmol﹣1
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com