
ЁОЬтФПЁПКьЦЯЬбОЦУмЗтДЂДцЪБМфдНГЄЃЌжЪСПдНКУЃЌдвђжЎвЛЪЧДЂДцЙ§ГЬжаЩњГЩСЫгаЯуЮЖЕФѕЅЁЃдкЪЕбщЪввВПЩвдгУШчЭМЫљЪОЕФзАжУжЦШЁввЫсввѕЅЃЌЧыЛиД№ЯТСаЮЪЬтЁЃ
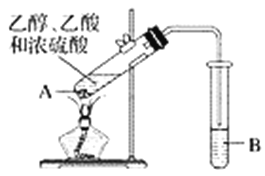
ЃЈ1ЃЉЪдЙмAЛьКЯШмвКЕФМгШыЫГађЪЧ__________________________________ЁЃ
ЃЈ2ЃЉЪдЙмAжаМгШыМИПщЫщДЩЦЌЕФФПЕФЪЧ______________________ЁЃ
ЃЈ3ЃЉЪдЙмAжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ______________ЃЌЗДгІРраЭЪЧ__________ЁЃ
ЃЈ4ЃЉЗДгІПЊЪМЧАЃЌЪдЙмBжаЪЂЗХЕФШмвКЪЧ_______________________ЁЃ
ЃЈ5ЃЉЪдЙмBжаПЩФмЙлВьЕНЕФЯжЯѓЪЧ______________________________ЁЃ
ЃЈ6ЃЉНЋЪдЙмBжаЕФЮяжЪЗжРыЕУЕНввЫсввѕЅЃЌБиаыЪЙгУЕФвЧЦїЪЧ________ЃЌОпЬхВйзїЪЧНЋввЫсввѕЅДгИУвЧЦїЕФ________________________(ЬюЁАЯТПкЗХГіЁБЛђЁАЩЯПкЕЙГіЁБ)ЁЃ
ЁОД№АИЁП ЯШМгШыввДМЁЂдйМгШыХЈСђЫсЁЂзюКѓМгШыввЫс ЗРжЙвКЬхБЉЗа CH3COOHЃЋCH3CH2OH![]() CH3COOC2H5ЃЋH2O ѕЅЛЏЗДгІ(ЛђШЁДњЗДгІ) БЅКЭЬМЫсФЦШмвК вКУцЩЯгаЭИУїВЛШмгкЫЎЁЂОпгаЯуЮЖЕФгЭзДвКЬхЩњГЩ ЗжвКТЉЖЗ ЩЯПкЕЙГі
CH3COOC2H5ЃЋH2O ѕЅЛЏЗДгІ(ЛђШЁДњЗДгІ) БЅКЭЬМЫсФЦШмвК вКУцЩЯгаЭИУїВЛШмгкЫЎЁЂОпгаЯуЮЖЕФгЭзДвКЬхЩњГЩ ЗжвКТЉЖЗ ЩЯПкЕЙГі
ЁОНтЮіЁПЃЈ1ЃЉИљОнХЈСђЫсШмгкЫЎЗХШШЗжЮіЃЛ
ЃЈ2ЃЉМгШыМИПщЫщДЩЦЌЃЌПЩЗРжЙвКЬхМгШШЪБОчСвЗаЬкЃЛ
ЃЈ3ЃЉввДМЁЂввЫсЗЂЩњѕЅЛЏЗДгІЩњГЩввЫсввѕЅКЭЫЎЃЌѕЅЛЏЗДгІЮЊШЁДњЗДгІЃЛ
ЃЈ4ЃЉBжаЮЊЬМЫсФЦЃЌПЩГ§ШЅввЫсЁЂЮќЪеввДМЁЂНЕЕЭввЫсввѕЅЕФШмНтЖШЃЛ
ЃЈ5ЃЉИљОнввЫсввѕЅЕФаджЪНтД№ЃЛ
ЃЈ6ЃЉИљОнввЫсввѕЅВЛШмгкЫЎХаЖЯЁЃ
ЃЈ1ЃЉХЈСђЫсШмгкЫЎЗХШШЃЌУмЖШДѓгкЫЎЃЌЧвгаЛњЮявзЛгЗЂЃЌдђЪдЙмAЛьКЯШмвКЕФМгШыЫГађЪЧЯШМгШыввДМЁЂдйМгШыХЈСђЫсЁЂзюКѓМгШыввЫсЃЛ
ЃЈ2ЃЉЪдЙмAжаМгШыМИПщЫщДЩЦЌЕФФПЕФЪЧЗРжЙБЉЗаЃЛ
ЃЈ3ЃЉЪдЙмAжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊCH3COOHЃЋCH3CH2OH![]() CH3COOC2H5ЃЋH2OЃЌЗДгІРраЭЮЊѕЅЛЏЃЈШЁДњЃЉЗДгІЃЛ
CH3COOC2H5ЃЋH2OЃЌЗДгІРраЭЮЊѕЅЛЏЃЈШЁДњЃЉЗДгІЃЛ
ЃЈ4ЃЉБЅКЭЬМЫсФЦШмвКЕФзїгУЪЧШмНтввДМЁЂЮќЪеввЫсЁЂНЕЕЭввЫсввѕЅЕФШмНтЖШЃЌдђЗДгІПЊЪМЧАЃЌЪдЙмBжаЪЂЗХЕФШмвКЪЧБЅКЭЬМЫсФЦШмвКЃЛ
ЃЈ5ЃЉввЫсввѕЅВЛШмгкЫЎЃЌдђЪдЙмBжаЕФЪЕбщЯжЯѓЪЧвКУцЩЯгаЭИУїВЛШмгкЫЎЁЂОпгаЯуЮЖЕФгЭзДвКЬхЩњГЩЃЛ
ЃЈ6ЃЉввЫсввѕЅВЛШмгкЫЎЃЌдђНЋЪдЙмBжаЕФЮяжЪЗжРыЕУЕНввЫсввѕЅашвЊЗжвКЃЌБиаыЪЙгУЕФвЧЦїЪЧЗжвКТЉЖЗЁЃгЩгкввЫсввѕЅУмЖШаЁгкЫЎЃЌдкЩЯВуЃЌдђОпЬхВйзїЪЧНЋввЫсввѕЅДгИУвЧЦїЕФЩЯПкЕЙГіЁЃ


 УПШе10ЗжжгПкЫуаФЫуЫйЫуЬьЬьСЗЯЕСаД№АИ
УПШе10ЗжжгПкЫуаФЫуЫйЫуЬьЬьСЗЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕчЖЏЙЋНЛГЕЬцДњШМгЭЙЋНЛГЕЪЧНкФмМѕХХЁЂПижЦЮэіВЕФживЊОйДыжЎвЛЃЌЯТЭМЫљЪОЕчГиЪЧвЛжже§дкПЊЗЂЕФГЕдиЕчГиЁЃгаЙиИУЕчГиЕФЫЕЗЈе§ШЗЕФЪЧ
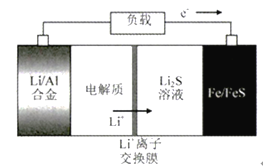
A. ЗХЕчЪБFe/FeSМЋЪЧИКМЋ
B. ЗХЕчЪБИКМЋЗДгІЪНЮЊЃКAl-3e-=Al3+
C. ГфЕчЪБбєМЋЗДгІЪНЮЊЃКFe+S2--2e-=FeS
D. зѓБпЕчНтжЪПЩвдЪЧLiOHЕФДМШмвК
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПАДвЊЧѓЬюПеЃК
ЃЈ1ЃЉєЧЛљЕФЕчзгЪНЃЛ
ЃЈ2ЃЉЯрЖдЗжзгжЪСПЮЊ72ЧвЗаЕузюЕЭЕФЭщЬўЕФНсЙЙМђЪНЃЛ
ЃЈ3ЃЉКЯГЩИпОлЮя  ЦфЕЅЬхЕФНсЙЙМђЪНЃЛ
ЦфЕЅЬхЕФНсЙЙМђЪНЃЛ
ЃЈ4ЃЉ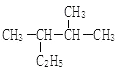 ЕФУћГЦЃЈЯЕЭГУќУћЗЈЃЉ ЃЎ
ЕФУћГЦЃЈЯЕЭГУќУћЗЈЃЉ ЃЎ
ЃЈ5ЃЉМзЭщОпгааЭЕФПеМфНсЙЙЃЌЖјввШВдђОпгааЭПеМфНсЙЙЃЎ
ЃЈ6ЃЉБНЗггіFeCl3ШмвКЛсЯдЩЋЃЛЕААзжЪгыХЈЯѕЫсЙВШШЛсБфЩЋЃЛЕэЗлгіЕтдђЯдЩЋЃЎетаЉЬиадГЃБЛгУгкЮяжЪЕФМьбщЛђМјБ№ЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФмгУH++OH-=H2OРДБэЪОЕФЛЏбЇЗДгІЪЧЃЈ ЃЉ
A.ЧтбѕЛЏУОКЭЯЁбЮЫсЗДгІ
B.BaЃЈOHЃЉ2ШмвКЕЮШыЯЁСђЫсжа
C.ГЮЧхЪЏЛвЫЎКЭЯЁЯѕЫсЗДгІ
D.ЖўбѕЛЏЬМЭЈШыГЮЧхЪЏЛвЫЎжа
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌЯТСаИїзщРызгдкЯргІЕФЬѕМўЯТПЩФмДѓСПЙВДцЕФЪЧЃЈЁЁЁЁЃЉ
A.ФмЪЙpHЪджНБфКьЕФШмвКжаЃКCO32ЉЁЂK+ЁЂClЉЁЂNa+
B.![]() ЈT10Љ10mol/LЕФШмвКжаЃКNa+ЁЂHCO3ЉЁЂClЉЁЂK+
ЈT10Љ10mol/LЕФШмвКжаЃКNa+ЁЂHCO3ЉЁЂClЉЁЂK+
C.дкcЃЈOHЉЃЉ/cЃЈH+ЃЉ=1ЁС1012ЕФШмвКжаЃКNH4+ЁЂFe2+ЁЂClЉЁЂNO3Љ
D.гЩЫЎЕчРыВњЩњЕФcЃЈOHЉЃЉ=1ЁС10Љ12mol/LЕФШмвКжаЃКNO3ЉЁЂMg2+ЁЂNa+ЁЂSO42
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПОпгаПЙОњзїгУЕФАзЭЗЮЬЫибмЩњЮяNЕФКЯГЩТЗЯпШчЯТЭМЫљЪО:
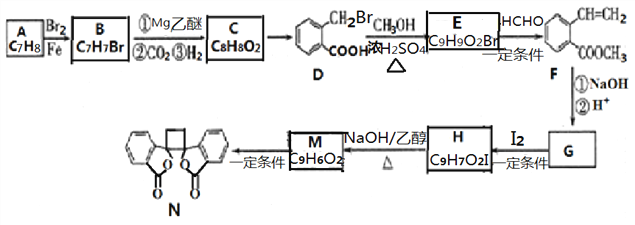
вбжЊ: iЃЎ 
iiЃЎ 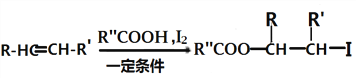
iiiЃЎ  (вдЩЯRЁЂRЁЂRЈДњБэЧтЁЂЭщЛљЛђЗМЛљЕШ)
(вдЩЯRЁЂRЁЂRЈДњБэЧтЁЂЭщЛљЛђЗМЛљЕШ)
ЛиД№ЯТСаЮЪЬт:
ЃЈ1ЃЉЮяжЪBЕФУћГЦЪЧ_______ЃЌЮяжЪDЫљКЌЙйФмЭХЕФУћГЦЪЧ_______ ЁЃ
ЃЈ2ЃЉЮяжЪCЕФНсЙЙМђЪНЪЧ_______ЁЃгЩCЁњDЕФЗДгІРраЭЮЊ_______ЁЃ
ЃЈ3ЃЉгЩHЩњГЩMЕФЛЏбЇЗНГЬЪНЮЊ_______ЁЃ
ЃЈ4ЃЉFЕФЭЌЗжвьЙЙЬхжаЃЌЗћКЯЯТСаЬѕМўЕФга______жж(АќКЌЫГЗДвьЙЙ)ЃЌаДГіКЫДХЙВеёЧтЦзга6зщЗхЁЂУцЛ§БШЮЊ1:1:1:2:2:3ЕФвЛжжгаЛњЮяЕФНсЙЙМђЪН____________ЁЃ
ЬѕМў:ЂйЗжзгжаКЌгаБНЛЗ,ЧвБНЛЗЩЯгаСНИіШЁДњЛљЂкДцдкЫГЗДвьЙЙ
ЂлФмгыЬМЫсЧтФЦЗДгІЩњГЩCO2
ЃЈ5ЃЉаДГігУввЯЉКЭввШЉЮЊдСЯжЦБИЛЏКЯЮя ЕФКЯГЩТЗЯп (ЦфЫћЪдМСШЮбЁ)ЁЃ________
ЕФКЯГЩТЗЯп (ЦфЫћЪдМСШЮбЁ)ЁЃ________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯжгУ0.1mol/LHClЕЮЖЈ10ml 0.05mol/LЧтбѕЛЏФЦШмвКЃЌШєЫсЪНЕЮЖЈЙмЮДШѓЯДЃЌДяЕНжеЕуЪБЫљгУбЮЫсЕФЬхЛ§гІЪЧЃЈЁЁЁЁЃЉ
A.10mL
B.5mL
C.Дѓгк5Ml
D.аЁгк5mL
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГбаОПаЁзщЬНОПЕчНтFeCl2ШмвКЕФЕчМЋЗДгІВњЮя
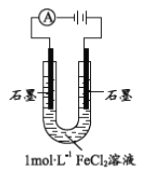
ЃЈ1ЃЉХфжЦ1molL-1FeCl2ШмвКЃЌВтЕУpH=4.91ЃЌдвђ______ЃЈгУРызгЗНГЬЪНБэЪОЃЉЁЃДгЛЏКЯМлНЧЖШЗжЮіЃЌ Fe2+Опга________ЁЃ
ЃЈ2ЃЉИУаЁзщЭЌбЇдЄВтЕчНтFeCl2ШмвКСНМЋЕФЯжЯѓЃКбєМЋгаЛЦТЬЩЋЦјЬхВњЩњЃЌвѕМЋгаЮоЩЋЦјЬхВњЩњЁЃ
ИУаЁзщЭЌбЇгУгвЭМзАжУЕчНт1molL-1FeCl2ШмвКЃК
ЂйШЁЩйСПвјЛвЩЋЙЬЬхЯДЕгКѓЃЌМгЯЁH2SO4гаЦјХнВњЩњЃЌдйЯђШмвКжаМгШы________ЃЈЪдМСКЭЯжЯѓЃЉЃЌжЄУїИУЙЬЬхЮЊFeЁЃ
ЂкИУаЁзщЭЌбЇНјвЛВНЗжЮіКьКжЩЋЙЬЬхВњЩњЕФдвђЃЌМзЭЌбЇШЯЮЊ________ЃЛввЭЌбЇШЯЮЊ2Cl- - 2e- = Cl2ЁќЃЌCl2ПЩбѕЛЏFe2+зюжеЩњГЩFeЃЈOHЃЉ3 ЁЃ
ЮЊжЄЪЕНсТлЃЌЩшМЦЗНАИШчЯТЃКгУЪЕбщЂёЕФзАжУКЭ1.5v ЕчбЙЃЌЕчНтЫсЛЏЃЈpH=4.91ЃЉЕФ_______ЃЌЭЈЕч5ЗжжгКѓЃЌбєМЋЮоУїЯдЯжЯѓЃЌжЄЪЕввЭЌбЇЕФЭЦТлВЛе§ШЗЁЃБћЭЌбЇШЯЮЊШдВЛбЯНїЃЌдвђЪЧВњЩњЕФЦјЬхШмгкЫЎЃЌМЬајЪЕбщ________ЃЈВйзїКЭЯжЯѓЃЉЃЌНјвЛВНжЄЪЕСЫввЭЌбЇЕФЭЦТлВЛе§ШЗЁЃ
ЃЈ3ЃЉИУаЁзщЭЌбЇНјвЛВНЬНОПЕчНт1molL-1FeCl2ШмвКЕчМЋВњЮяЕФгАЯьвђЫиЁЃ
ЪЕбщ | ЬѕМў | ВйзїМАЯжЯѓ | ||
ЕчбЙ | pH | бєМЋ | вѕМЋ | |
Ђё | 1.5v | 4.91 | ЮоЦјХнВњЩњЃЌШмвКж№НЅБфЛызЧЃЌ5ЗжжгКѓЕчМЋБэУцЮіГіКьКжЩЋЙЬЬх | ЮоЦјХнВњЩњЃЌ4ЗжжгКѓЕчМЋБэУцгавјЛвЩЋН№ЪєзДЙЬЬхИНзХ |
Ђђ | 1.5v | 2.38 | ЮоЦјХнВњЩњЃЌШмвКГіЯжЩйСПЛызЧЃЌЕЮМгKSCNШмвКБфКьЩЋ | ЮоЦјХнВњЩњЃЌЕчМЋБэУцгавјЛвЩЋН№ЪєзДЙЬЬхИНзХ |
Ђѓ | 1.5v | 1.00 | ЮоЦјХнВњЩњЃЌШмвКЮоЛызЧЯжЯѓЃЌЕЮМгKSCNШмвКБфКьЩЋ | гаЦјХнВњЩњЃЌЮоЙЬЬхИНзХ |
Ђє | 3.0v | 4.91 | ЮоЦјХнВњЩњЃЌШмвКж№НЅБфЛызЧЃЌ3ЗжжгКѓЕчМЋБэУцгаКьКжЩЋЙЬЬхВњЩњ | МЋЩйСПЦјХнВњЩњЃЌ1ЗжжгГіЯжЖЦВуН№Ъє |
Ђѕ | 6.0v | 4.91 | гаЦјХнВњЩњЃЌгіЪЊШѓЕФЕэЗлЕтЛЏМиЪджНБфРЖЁЃШмвКж№НЅБфЛызЧ | ДѓСПЦјХнВњЩњЃЌбИЫйГіЯжЖЦВуН№Ъє |
ЂйЖдБШЪЕбщЂёЁЂЂђЁЂЂѓПЩвдЕУГіНсТлЃК
бєМЋFe2+ЗХЕчЪБЃЌЫсадНЯЧПжївЊЩњГЩFe3+ЃЛ ЫсадНЯШѕжївЊЩњГЩFeЃЈOHЃЉ3 ЁЃвѕМЋ________ЁЃ
ЂкЖдБШЪЕбщЂёЁЂЂєЁЂЂѕПЩвдЕУГіНсТлЃК
діДѓЕчбЙЃЌВЛНіПЩвдИФБфРызгЕФЗХЕчФмСІЃЌвВПЩвд________ЁЃ
ЃЈ4ЃЉзлКЯЗжЮіЩЯЪіЪЕбщЃЌЕчНтЙ§ГЬжаЕчМЋЗДгІЕФВњЮягы________гаЙи ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЗДгІ4A(s)+3B(g)==2C(g)+D(g)ЃЌО2minКѓBЕФХЈЖШМѕЩй0.6molЁЄL-1ЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. гУAБэЪОЕФЗДгІЫйТЪЪЧ0.4molЁЄL-1ЁЄmin-1
B. дк2minФЉЕФЗДгІЫйТЪЃЌгУBБэЪОЪЧ0.3 molЁЄL-1ЁЄmin-1
C. ЗжБ№гУBЁЂCЁЂDБэЪОЗДгІЕФЫйТЪЃЌЦфБШжЕЪЧ3:2:1
D. дкет2minФкBКЭCСНЮяжЪХЈЖШЪЧж№НЅМѕаЁЕФ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com