
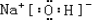 ,故答案为:
,故答案为: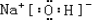 ;
;| 0.4x-0.1y |
| x+y |


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:

| A、稀硝酸对Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱 |
| B、随着Cr含量增加,稀硝酸对Fe-Cr合金的腐蚀性减弱 |
| C、Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强 |
| D、稀硝酸和过量铁反应的化学方程式是:Fe+4HNO3(稀)═Fe(NO3)3+NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、定容摇匀后,有少量溶液外流,则NaClO的物质的量浓度偏小 |
| B、容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制 |
| C、所配得的NaClO消毒液在空气中光照,久置后溶液中NaClO的物质的量浓度减小 |
| D、需要称量的NaClO固体的质量为142.8 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4 | B、3 | C、2 | D、1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定条件下,1molN2和3molH2充分反应,生成物中的N-H键数目为6NA |
| B、完全燃烧1.5molCH3CH2OH和C2H4的混合物,转移电子数为18NA |
| C、100g 98%的浓硫酸中含氧原子个数为4NA |
| D、1L 0.1 mol/L的Na2S溶液中S2-和HS-的总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32克O2和O3 的混合气体中含有的氧原子个数为2NA | ||
| B、Na2O2与水反应,当有2 mol的Na2O2作氧化剂,转移的电子数目为2NA | ||
C、CO2通过Na2O2,使其增重b克,反应中转移的电子数为
| ||
| D、标况下.22.4LHCL 溶于水后溶液中含NA个HCl分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com