
【题目】化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳。而氢气和氮气都被认为是无碳无污染的清洁能源。
Ⅰ.“氢能”将是未来最理想的新能源。
(1)某些合金可用于储存氢,金属储氢的原理可表示为M(s)+xH2═MH2x(s) △H<0(M表示某种合金)。图甲表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系。

下列说法中正确的是___(填字母代号)。
a.T1>T2
b.增大M的量,上述平衡向右移动
c.增大氢气压强,加快氢气的吸收速率
d.金属储氢过程中M作还原剂,价态升高
(2)工业上通常用生产水煤气的方法制得氢气。其中C(s)+H2O(g)![]() CO(g)+H2(g) △H>0,在850℃时平衡常数K=1。若向1L的恒容密闭真空容器中同时加入xmolC和6.0molH2O。
CO(g)+H2(g) △H>0,在850℃时平衡常数K=1。若向1L的恒容密闭真空容器中同时加入xmolC和6.0molH2O。
①850℃时反应达到平衡,x应满足的条件是_____。
②对于上述平衡状态,改变下列条件能使反应速率增大,且平衡向正向移动的是____(填字母代号)。
a.选用更高效的催化剂
b.升高温度
c.及时分离出氢气
d.增加氢气的浓度
Ⅱ.CO2是合成尿素的原料。
现以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如装置乙所示),其中负极通入H2,正极通入O2和CO2的混合气体。装置丙中a、b为石墨,电解一段时间后,b电极附近滴入酚酞溶液变红,NaCl溶液的体积为100mL。
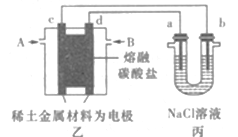
(1)工作过程中,装置乙中电极c为____(填电极名称)极。
(2)若在a极产生112mL(标准状况)气体,25℃时丙装置中所得溶液pH=____(忽略电解前后溶液体积变化,不考虑气体的溶解)。
Ⅲ.氨是制备尿素的原料。NH3、N2O4等在工农业生产、航天航空等领域有广泛应用。
(1)氨在氧气中燃烧,生产水和一种空气组成成分的单质。已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol,H2的燃烧热为286kJ/mol。试写出氨在氧气中燃烧生成液态水的热化学方程式:________________________。
2NH3(g) △H=-92.4kJ/mol,H2的燃烧热为286kJ/mol。试写出氨在氧气中燃烧生成液态水的热化学方程式:________________________。
(2)氨气溶于水得到氨水,在25℃下,将amol·L-1的氨水和bmol·L-1的硫酸溶液以3:2的体积比混合,反应后溶液呈中性。用含a和b的代数式表示出NH3·H2O的电离平衡常数:___________。
(3)用氨水除去SO2,已知25℃时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol·L-1,将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol·L-1时,溶液中离子浓度从大到小的关系是_________________。
【答案】cd x>2 b 负 13 4NH3(g)+3O2(g)===2N2(g)+6H2O(l) △H=-1531.2kJ/mol ![]() ×10-7 c(NH4+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
×10-7 c(NH4+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
【解析】
Ⅰ.(1)在压强相同的条件下,T1对应的吸氢量大,也就是T2→T1,平衡正向移动,而正反应是放热反应,平衡常数是温度的函数,温度不变平衡常数不变,结合表达式分析求解;
(2)①设转化的水为amol,根据平衡常数进行计算;
②化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,结合影响化学反应速率的因素和影响化学平衡的影响因素,以此进行判断,得出正确结论。
Ⅱ.(1)以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如图乙所示),其中负极通入H2,正极通入O2和CO2的混合气体,图丙装置中a、b为石墨电极,电解一段时间后,b电极附近滴入酚酞溶液变红,说明溶液中氢离子得到电子发生还原反应,则b电极为电解池阴极,a为电解池阳极,和b电极相连的电极c电极为负极,与a电极相连的d电极为原电池正极。
(2)依据电极反应和电子守恒计算。
Ⅲ.(1)根据盖斯定律求解。
(2)根据电荷守恒:c(H+)+c(NH4+)=c(OH-)+2c(SO42-),现已知c(H+)=c(OH-),所以c(NH4+)=2c(SO42-);然后根据Kb(NH3H2O)得出。
(3)当c(OH-)降至1.0×10-7mol·L-1时,c(H+)=1.0×10-7mol·L-1,根据H2SO3的Ka2=6.2×10-8= c(SO32-)c(H+)/ c(HSO3-),其中已知c(H+),代入计算,可得到c(SO32-)/ c(HSO3-)=6.2×10-8/1.0×10-7=0.62<1,所以c(HSO3-)>c(SO32-),该溶液为亚硫酸铵和亚硫酸氢铵的混合液,故铵根离子浓度最大,最小的是氢离子和氢氧根离子浓度。
Ⅰ. (1)a.在压强相同的条件下,T1对应的吸氢量大,也就是T2→T1,平衡正向移动,而正反应是放热反应,所以T2→T1,是降温,所以T2>T1,故a错误;
b.M为固体,增大M的量,浓度不变,上述平衡不移动,故b错误;
c.增大氢气压强,反应速率加快,氢气的吸收速率加快,故c正确;
d.金属储氢的原理可表示为:M(s)+xH2═MH2x(s)△H<0 平衡可以正向或逆向进行,反应可实现多次储存和释放氢气,金属储氢过程中M做还原剂,价态升高,故d正确;
故答案为:cd;
(2)① C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
起(mol) 6 0 0
转(mol) a a a
平(mol) 6-a a a
K= a×a/ 6-a=1, a=2,故x应满足的条件是x>2,故答案为:x>2。
②a.选用更高效的催化剂增大反应速率,平衡不变,故a错误;
b.反应为吸热反应,升高温度,反应速率增大,平衡正向进行,故b正确;
c.及时分离出氢气平衡正向进行,但反应速率减小,故c错误;
d.增加氢气的浓度平衡逆向进行,反应速率增大,故d错误;
故答案为:b;
Ⅱ. (1)图丙装置中a、b为石墨电极,电解一段时间后,b电极附近滴入酚酞溶液变红,说明溶液中氢离子得到电子发生还原反应,则b电极为电解池阴极,a为电解池阳极,和b电极相连的电极c为负极,与a电极相连的d电极为原电池正极,故装置乙中电极c为负极,故答案为:负;
(2)依据电极反应和电子守恒计算,a极为电解池阳极,产生112mL(标准状况)气体为氢气,物质的量0.005mol,电极反应2H++2e-=H2↑,消耗氢离子物质的量为0.01mol,溶液中生成氢氧根离子物质的量为0.01mol,溶液中氢氧根离子浓度c(OH-)=0.01mol/0.1L=0.1mol/L,溶液中c(H+)=1014/0.1=10-13mol/L,溶液PH=13,故答案为:13;
Ⅲ.(1)已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol,H2的燃烧热为286kJ/mol,
2NH3(g) △H=-92.4kJ/mol,H2的燃烧热为286kJ/mol,
①N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol,
2NH3(g) △H=-92.4kJ/mol,
②2H2(g)+O2(g)═2H2O(1)△H=-572KJmo1-1,
根据盖斯定律计算②×3-①×2得出氨气在氧气中燃烧生成液态水的热化学方程式为:
4NH3(g)+3O2(g)===2N2(g)+6H2O(l) △H=-1531.2kJ/mol,故答案为:4NH3(g)+3O2(g)===2N2(g)+6H2O(l) △H=-1531.2kJ/mol 。
(2)根据电荷守恒:c(H+)+c(NH4+)=c(OH-)+2c(SO42-),现已知c(H+)=c(OH-),所以c(NH4+)=2c(SO42-);Kb(NH3H2O)=c(OH)c(![]() ×10-7,故答案为:
×10-7,故答案为:![]() ×10-7。
×10-7。
(3)当c(OH-)降至1.0×10-7mol·L-1时,c(H+)=1.0×10-7mol·L-1,根据H2SO3的Ka2=6.2×10-8= c(SO32-)c(H+)/ c(HSO3-),其中已知c(H+),代入计算,可得到c(SO32-)/ c(HSO3-)=6.2×10-8/1.0×10-7=0.62<1,所以c(HSO3-)>c(SO32-),该溶液为亚硫酸铵和亚硫酸氢铵的混合液,故铵根离子浓度最大,最小的是氢离子和氢氧根离子浓度,故溶液中离子浓度从大到小的关系是c(NH4+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),
故答案为:c(NH4+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)。


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】化合物I(戊巴比妥)是临床常用的镇静、麻醉药物,其合成路线如下:

已知:R、R、R代表烃基,R代表烃基或氢原子。
ⅰ. 
ⅱ. ![]()
ⅲ. 
回答下列问题:
(1)F→G的反应类型是_________________。
(2)A的化学名称是_____________________。
(3)试剂a的结构简式_____________________。
(4)I的结构简式_____________________。
(5)B、C互为同分异构体,写出B→D的化学方程式_____________________。
(6)写出E→F的化学方程式_____________________。
(7)以A和另一种有机化合物及必要的无机试剂可合成B,则B的合成路线为______。
(用结构简式表示有机化合物,用箭头表示转化关系,箭头上或下注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想已成为现实。某化学兴趣小组在实验室中模拟上述过程(反应缓慢不发生爆炸),其设计的模拟装置如下:

根据要求填空:
(1)仪器F的名称______________;A中反应的离子反应方程式___________________。
(2)B装置有三种功能:①控制气流速度;②均匀混合气体③______________________。
(3)为了除多余的氯气,D装置中的石棉网均匀附着KI粉末,你认为能否换成碱石灰______(填“能”或“不能”)。
(4)E装置的作用________。
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(5)E装置中除了盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为一定条件下采用多孔惰性电极的储氢电池充电装置(忽略其他有机物)。已知储氢装置的电流效率![]() ×100%,下列说法不正确的是
×100%,下列说法不正确的是
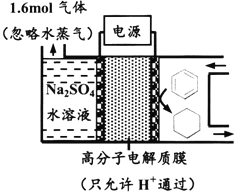
A. 采用多孔电极增大了接触面积,可降低电池能量损失
B. 过程中通过C-H键的断裂实现氢的储存
C. 生成目标产物的电极反应式为C6H6+6e-+6H+===C6H12
D. 若![]() =75%,则参加反应的苯为0.8mol
=75%,则参加反应的苯为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型药物H(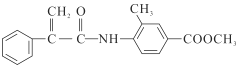 )是一种可用于治疗肿瘤的药物,其合成路线如图所示:
)是一种可用于治疗肿瘤的药物,其合成路线如图所示:

已知:
(1)E的分子式为C9H8O2,能使溴的四氯化碳溶液褪色;
(2)RCOOH![]()
![]() ;
;
(3)![]() +R1NH2
+R1NH2![]()
![]() +HBr。(以上R,R1均为烃基)
+HBr。(以上R,R1均为烃基)
请回答下列问题:
(1)A的结构简式为___________;E的官能团的名称为___________。
(2)①的反应类型是________;④的反应条件是__________。
(3)写出C→D的化学方程式:______________________。
(4)写出F+G→H的化学方程式:_________________________________________。
(5)E有多种同分异构体,同时满足下列条件的E的同分异构体有____(考虑顺反异构)种。
i.能发生银镜反应;
ii.能发生水解反应;
iii.分子中含的环只有苯环。
(6)参照H的上述合成路线,设计一条由乙醛和NH2CH(CH3)2为起始原料制备医药中间体CH3CONHCH(CH3)2的合成路线__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池是以表面涂有钌(Rii)基配合物的TiO2光敏染料的透明导电玻璃和镀Pt导电玻璃为极板。其工作原理如下图所示:

下列关于该电池叙述正确的是
A. 电池工作时电能由光能直接转化而来,不涉及化学能转化
B. 电池工作的总反应为:RuII+I3-=RuIII+3I-
C. 当太阳光照射光敏染料时,光敏染料所在电极的电势低于镀Pt导电玻璃电极
D. 电池工作时,为持续供电,需要定期补充有关电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将100mL某盐酸和硫酸的混合溶液分成两等份。一份加入过量BaCl2溶液,充分反应后得沉淀2.33g;另一份加入50mL1.0mol·L-1NaOH溶液,充分反应后溶液的 c(OH-)=0.1mol·L-1(反应后溶液的体积为100mL)。试计算:
(1)每份溶液中所含H2SO4的物质的量______________mol。
(2)原混合溶液中盐酸的物质的量浓度_____________mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员借助太阳能,将光解水制H2与脱硫结合起来,既能大幅度提高光解水制H2的效率,又能脱除SO2,工作原理如图所示。下列说法不正确的是
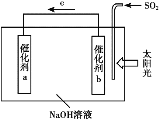
A. 该装置可将太阳能转化为化学能
B. 催化剂a表面发生还原反应,产生H2
C. 催化剂b附近的溶液pH增大
D. 吸收1 mol SO2,理论上能产生1 mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com