
【题目】把足量熟石灰放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
A. 向溶液中加入少量的NaOH固体,则其中的Ca(OH)2的固体增多
B. 向溶液中加入Na2CO3溶液,则其中的Ca(OH)2的固体增多
C. 恒温下向溶液中加入CaO,溶液的pH升高
D. 给溶液加热,溶液的pH升高
【答案】A
【解析】分析:A、加入少量的NaOH固体,平衡向逆反应方向移动;
B、加入Na2CO3溶液,平衡向正方向移动;
C、恒温下向溶液中加入CaO,仍为饱和溶液,浓度不变;
D、Ca(OH)2的溶解度随温度的升高而降低。
详解:A、加入少量的NaOH固体,OH-浓度增大,平衡向逆方向移动,则Ca(OH)2的固体增多,A正确。
B、加入Na2CO3溶液,发生Ca2++CO32-=CaCO3↓,平衡向正方向移动,则Ca(OH)2的固体减少,B错误;
C、恒温下向溶液中加入CaO,发生CaO+H2O=Ca(OH)2,仍为饱和溶液,pH不变,但是由于水量减少,故溶解的碳酸钙减小,C错误;
D、给溶液加热,Ca(OH)2的溶解度降低,溶液pH减小,D错误;答案选A。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】已知A是一种不溶于水的固体非金属氧化物,根据图中的转化关系,回答下列问题:
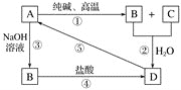
(1)写出化学式:A是____________,D是____________。
(2)写出相关反应的化学方程式:①____________,⑤____________。
(3)写出相关反应的离子方程式:②__________,③__________,④__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1)L的元素符号为________;M在元素周期表中的位置为___________;五种元素的原子半径从大到小的顺序是_______________(用元素符号表示)。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为______,B的化学式为____________,Z、X两种元素形成的一种既含离子键又含共价键的物质名称为:____________;
(3)硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物与足量烧碱溶液反应的化学方程式为____________。1mol铁跟足量的硒单质化合时,转移的电子数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)Ⅰ.化学课上老师演示了如下图的实验:
实验时,将两气球内的NaHCO3和Na2CO3同时倒入试管中。已知盐酸是足量的,且整套装置气密性良好,回答下列问题:
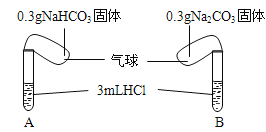
(1)实验过程中观察到的现象是:________________.
(2)实验结束后,两试管的气球大小有差异,大小气球(包含试管)体积之比约为(填最简单整数比)__________.
Ⅱ.当甲同学用手触摸上述试管时,意外发现A试管变冷,而B试管发热,他把这个发现告诉了同桌乙同学,并由此得出结论:NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.乙同学却对此结论却持怀疑的态度.为此,两位同学在课外活动中继续进行了下列实验(每次实验各做3次平行实验,取平均值):
序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后温度 |
① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
② | 35mL水 | 3.2g Na2CO3固体 | 20℃ | 24.3℃ |
③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10mL水 | 20℃ | 24.2℃ |
⑤ | 35mL稀盐酸 | 2.5g NaHCO3固体 | 20℃ | 16.2℃ |
⑥ | 35mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
请你帮助填写相关内容:
(1)该研究报告的题目是《___________________________》.
(2)该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称是______________________.
(3)实验①和②的目的是_________________________________________________.
(4)通过上述实验可得出的结论是:___________________________________(写出两条即可).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A. 光导纤维是以二氧化硅为主要原料制成的
B. 二氧化硅溶于水生成硅酸
C. 石英、水晶的主要成分都是二氧化硅
D. 二氧化硅是一种熔沸点很高、硬度很大的氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10-10。下列说法正确的是( )
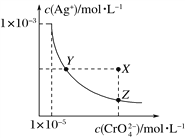
A. t ℃时,Ag2CrO4的Ksp为1×10-8;
B. t ℃时,将0.01 mol·L-1AgNO3溶液滴入20 mL0.01 mol·L-1 KCl和0.01 mol·L-1 K2CrO4的混合溶液中,CrO42-先沉淀;
C. t ℃时,Y点和Z点时Ag2CrO4的Ksp相等;
D. 饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为Z点;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮的循环和转化对生产、生活有重要的价值。
I.(1)写出实验室制备氨气的化学方程式________ 。
II.氨是重要的化工原料。某工厂用氨制硝酸和铵盐的流程如下图所示。
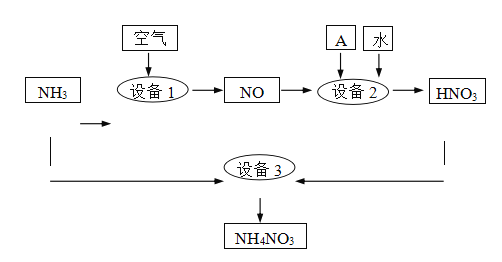
(2)设备1、3中发生反应的化学方程式分别是______、 ________ 。设备2中通入的物质A是________。
III.氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以NH4+和NH3H2O的形式存在。某工厂处理氨氮废水的流程如下:
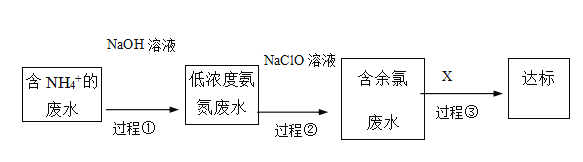
(3)过程①的目的是将NH4+转化为NH3,并通过鼓入大量空气将氨气吹出,写出NH4+转化为NH3的离子方程式________ 。
(4)过程②加入NaClO溶液可将氨氮转化为无毒物质,反应后含氮元素、氯元素的物质化学式分别为___、_______。
(5)含余氯废水的主要成分是NaClO以及HClO,X可选用以下哪种溶液以达到去除余氯的目的(填序号)_________。
a.KOH b.Na2SO3 c.KMnO4 D.NaCl
写出其中一个反应的离子方程式__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的说法正确的是( )
A.Na2O2、CaO、K2O都是碱性氧化物B.BaSO4、NaCl、KNO3溶液都是电解质
C.纯碱、烧碱、碱石灰都是碱D.稀豆浆、果冻、淀粉溶液都是胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,理想状态是反应物中的原子全部转化为欲制的产物,即原子利用率为100%。下列反应最符合绿色化学中“原子经济”要求的是
A. nCH2=CH2![]()
![]()
B. CH4+2Cl2![]() CH2Cl2+2HCl
CH2Cl2+2HCl
C. Cl2+2NaOH===NaCl+NaClO+H2O
D. 3NO2+H2O===2HNO3+NO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com