
【题目】下列说法中,不正确的是( )
A. 光导纤维是以二氧化硅为主要原料制成的
B. 二氧化硅溶于水生成硅酸
C. 石英、水晶的主要成分都是二氧化硅
D. 二氧化硅是一种熔沸点很高、硬度很大的氧化物
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化合物A的相对分子质量为136,分子式为C8H8O2。A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱和核磁共振氢谱如下图。下列关于A的说法中不正确的是


A. A分子属于酯类化合物,在一定条件下能发生水解反应
B. A在一定条件下可与3 mol H2发生加成反应
C. 与A属于同类化合物的同分异构体只有4种
D. 符合题干特征的A分子结构只有1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
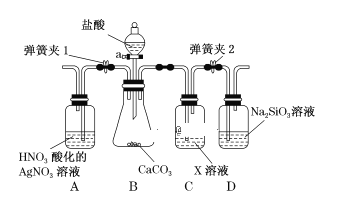
实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,…,关闭活塞a。请回答:
(1)B中反应的离子方程式是_________________________________________。
(2)通过步骤 Ⅰ、 Ⅱ 得知盐酸具有的性质是________(填字母)。
A.挥发性 B.还原性 C.氧化性 D.酸性
(3)C装置的作用是______________,X是____________________(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是_______________,D中反应的化学方程式是__________________________________。
(5)碳、硅的非金属性逐渐减弱的原因是_____________________(从原子结构角度加以解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卫生部严令禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。过氧化钙(CaO2)常用作杀菌剂、防腐剂,是一种白色固体,带有结晶水,通常还含有CaO。
I、制备过氧化钙。
某实验小组选用如下装置制备过氧化钙。已知化学反应Ca2++H2O2+2NH3+xH2O===CaO2·xH2O↓+2NH4+。在碱性环境中制取CaO2·xH2O的装置如下图:
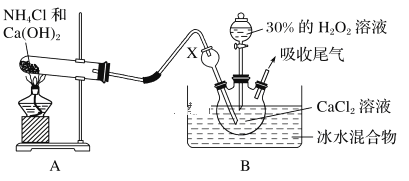
(1)装置B中仪器X的作用是_____________;反应在冰水浴中进行的原因是_________________。
(2)反应结束后,经________、________、低温烘干获得CaO2·xH2O。
II、含量测定。
(1)称取13.52 g过氧化钙样品,灼热时发生如下反应:2[CaO2·xH2O]→2CaO+O2↑+2xH2O,得到O2在标准状况下体积为672 mL,该样品中CaO2的物质的量为____________。
(2)另取同一样品13.52 g,溶于适量稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 7.0 g。样品中杂质CaO的质量为_____________;样品CaO2·xH2O中的x值为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是
方法 | 现象 | 结论 | |
A | 观察氯水颜色 | 氯水呈黄绿色 | 氯水中含Cl2 |
B | 向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
C | 向红色纸条上滴加氯水 | 红色纸条褪色 | 氯水具有漂白性 |
D | 向FeCl2溶液中滴加氯水 | 溶液变成棕黄色 | 氯水具有氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把足量熟石灰放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
A. 向溶液中加入少量的NaOH固体,则其中的Ca(OH)2的固体增多
B. 向溶液中加入Na2CO3溶液,则其中的Ca(OH)2的固体增多
C. 恒温下向溶液中加入CaO,溶液的pH升高
D. 给溶液加热,溶液的pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,有两种溶液:①0.01 mol·L-1 NH3·H2O溶液、②0.01 mol·L-1 NH4Cl溶液,下列操作可以使两种溶液中c(NH)都增大的是( )
A. 加入少量H2O B. 加入少量HCl气体 C. 加入少量NaOH固体 D. 升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到固体TiO2。用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为______________________
(2)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是:____________;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的________(填字母代号)。
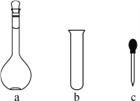
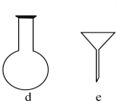
(3)滴定终点的现象是________________________________________。
(4)检验TiO2·xH2O中Cl-是否被除净的方法是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同,A、G的焰色反应为黄色。在一定条件下,各物质相互转化关系如右图。请回答:
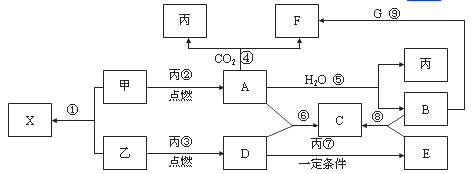
(1)X的电子式为____________________,写出E的化学式:____________。
(2)写出B与G溶液反应生成F的离子方程式:____________________________。
(3)写出A与H2O反应的化学反应方程式:______________________________ 。
(4)在上图的反应中,不属于氧化还原反应的是(填序号)___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com