
����Ŀ�����ҹ����ຣʡ�������κ�ʢ��ʳ�Σ�������ʳ�ι�ϵ���У�ʳ�����ϰ���������ִ����Ĺ�ũҵ�����о�����Ҫ���á������к�Ca2+��Mg2+��SO42���Լ���ɳ�����ʣ�Ϊ�˳�ȥ���������ʣ�������ʵ�鲽������ᴿ��
�ٹ��� �ڼӹ���NaOH��Һ �ۼ��������� �ܼӹ���Na2CO3��Һ �ݼӹ���BaCl2��Һ��
��1�����²���˳�������� _______��
A���ڢݢܢۢ� B���ܢݢڢ٢� C���ݢڢܢ٢� D���ݢܢڢ٢�
��2�����ᴿ��NaCl����450 mL 4.00 mol��L��1NaCl��Һ��������������ƽ��ҩ�ס��ձ������������________(����������)��
��3��ͨ��������й��˺����Һ������SO42���Ƿ�����IJ���������_________________________
����100 mL NaOH��Һ��ͨ��һ������CO2���壬��ַ�Ӧ������������Һ����μ���2.0 mol/L�����ᣬ����CO2������������������֮���ϵ��ͼ��ʾ���ش��������⣺

(1)ͼ1��ͨ��CO2��������Һ�����ʳɷ�Ϊ____________________��
(2)ͼ3��ͨ��CO2��������Һ�����ʳɷ�Ϊ____________________��
����֪����þ������ˮ��Ӧ��Mg3N2��6H2O===2NH3����3Mg(OH)2������������þ�����ڿ���ȼ�գ����ܻᷢ�����з�Ӧ��2Mg+O2![]() 2MgO;��3Mg+N2
2MgO;��3Mg+N2![]() Mg3N2;��2Mg+CO2
Mg3N2;��2Mg+CO2![]() 2MgO+C;��Mg+H2O(g)
2MgO+C;��Mg+H2O(g)![]() MgO+H2�������һ��ʵ��,��֤�����к��е���þ��Mg3N2��:_________________________��
MgO+H2�������һ��ʵ��,��֤�����к��е���þ��Mg3N2��:_________________________��
���𰸡�AB 500 mL����ƿ����ͷ�ι� ȡ������Һ��һ֧�Թ��У��μ�BaCl2��Һ�����Թ��е���Һ�����Ա仯��֤��SO42���ѳ��������Թ��е���Һ���ֻ�����֤��SO42��δ������ Na2CO3 Na2CO3��NaOH ȡ������������Թ���,�μ�����ˮ,����ʪ�ĺ�ɫʯ����ֽ�����Թܿ�,�����ɫʯ����ֽ����,�����֤���е���þ����
��������
��1���ڴ����ᴿʱ��Ҫ�����һ���������ᣬ̼���Ƽ����Ȼ����ĺ��棬���ݳ���ԭ���������
��2����������һ��Ũ�ȵı���Һ�Ļ����������������ȱ�ٵ�������
��3������SO42���Ƿ���������ж��Ȼ����Ƿ�������ݴ˷�������
����100 mLNaOH��Һ��ͨ��һ������CO2����25 mLʱ�����ܷ����ķ�Ӧ�У�2NaOH+CO2�TNa2CO3+H2O��NaOH+CO2�TNaHCO3�����ܵ��������Ϊ�� CO2��NaOH��1:2ʱ�����ʳɷ�ΪNa2CO3��NaOH���� CO2��NaOH = 1:2ʱ���ʳɷ�ΪNa2CO3����1:2��CO2��NaOH ��1:1ʱ�����ʳɷ�ΪNa2CO3��NaHCO3���� CO2��NaOH>1:1ʱ�����ʳɷ�ΪNaHCO3�����ͼ���ϵ����������
�����֪��Ϣ���ݵ���þ������ˮ��Ӧ���ɼ������就������
��1���ڴ����ᴿʱ��Ҫ�����һ���������ᣬ��ȥ���������������Ӻ�̼������ӣ�̼���Ƽ����Ȼ����ĺ���,��ȥ�����Ӻͼ���Ĺ����ı����ӣ�NaOH��Һ��þ���ӣ�˳���ڹ���ǰ���ɣ�������ȷ�IJ���˳��Ϊ���ݢڢܢ٢ۻ�ݢܢڢ٢ۣ���C��D����ȷ��A��B�����
��ѡAB��
��2������450 mL 4.00 mol��L��1NaCl��Һ����Ҫ500 mL����ƿ������ʱ��Ҫ��ͷ�ιܣ�����ȱ�ٵ�����Ϊ��500 mL����ƿ����ͷ�ιܣ�
�ʴ�Ϊ��500 mL����ƿ����ͷ�ιܣ�
��3����Һ������������Ƿ��������ͨ���μӹ����Ȼ��������жϣ�������������Ϊ��ȡ������Һ��һ֧�Թ��У��μ�BaCl2��Һ�����Թ��е���Һ�����Ա仯��֤��SO42���ѳ��������Թ��е���Һ���ֻ�����֤��SO42��δ������
�ʴ�Ϊ��ȡ������Һ��һ֧�Թ��У��μ�BaCl2��Һ�����Թ��е���Һ�����Ա仯��֤��SO42���ѳ��������Թ��е���Һ���ֻ�����֤��SO42��δ������
��������������֪��ͼ1�м���HClʱ����ʼû�ж�����̼���ɣ��ų��ڢۡ����ֿ�������������μ�HClʱ���ж�����̼���ɣ���ǰ������HCl�������Ϊ1:1���ݴ˿�֪�ڢ����������������̼�պ����������ư�1:2��Ӧ��ȫ�������������Һ����Ϊ��Na2CO3��
ͼ3��Ϣ��ʾ��x:y = 1:1����������˼ά��������ӦΪ������̼�����ư����ʵ���֮��Ϊ1:1���ɶ�����̼�ķ�Ӧ���̣���˽η�Ӧ���������ΪV�����Կ���δ���ɶ�����̼֮ǰ����Ӧ������������Ϊ2V��ӦΪ����������̼���Ʒֱ�����V����������£�����������ͼ3��ͨ��CO2��������Һ�����ʳɷ�ΪNa2CO3��NaOH��
�ʴ�Ϊ��Na2CO3��Na2CO3��NaOH��
�����ڵ���þ������ˮ��Ӧ����ϻ�ѧ����ʽMg3N2��6H2O===2NH3����3Mg(OH)2����֪�����������е���þ�����ˮ��Ӧ���ɰ��������һ��ʵ�飬�����Ƿ��а����������Ƿ��е���þ���ɣ��������Ϊ��ȡ������������Թ��У��μ�����ˮ������ʪ�ĺ�ɫʯ����ֽ�����Թܿڣ������ɫʯ����ֽ����,�����֤���е���þ���ɣ�
�ʴ�Ϊ��ȡ������������Թ��У��μ�����ˮ������ʪ�ĺ�ɫʯ����ֽ�����Թܿڣ������ɫʯ����ֽ����,�����֤���е���þ���ɡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�aA��bB![]() cC�Ŀ��淴Ӧ�ﵽƽ�⣺
cC�Ŀ��淴Ӧ�ﵽƽ�⣺
��1����֪A��B��C�������壬�ڼ�ѹ��ƽ�����淴Ӧ�����ƶ�����a��b��c�Ĺ�ϵ�ǣ�_____��
��2����֪AΪ���塢BΪ��ɫ���塢C����ɫ���壬�ң�a��b��=c���ڼ�ѹʱ��ƽ����____�����ƶ����������ɫ��___��������dz�����䡱����
��3�����Ⱥ�C�������������٣�������Ӧ��___�ȷ�Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Һ����Ϊһ��DZ�ڵ��������ȼ����Խ��Խ�����ӡ����ڰ�ȫ�ԡ��۸�ȷ���ϻ�ʯȼ�Ϻ���ȼ�����Žϴ�����ơ�
��1������ȼ��ʵ���漰����������صķ�Ӧ��
��4NH3(g)+5O2(g)��4NO(g)+6H2O(l) ��H1
��4NH3(g)+6NO(g)��5N2(g)+6H2O(l) ��H2
��4NH3(g)+3O2(g)��2N2(g)+6H2O(l)�Ħ�H��_____��(���ú��Ц�H1����H2��ʽ�ӱ�ʾ)
��2����������ֱ������ȼ�ϵ�أ�ѡ�������Һ��Ϊ�������Һ��д�������ĵ缫��Ӧʽ__________��
��3����֪�ϳɰ���Ӧ�ķ���ʽΪN2+3H2![]() 2NH3����ƽ�ⳣ��K����ֵ���¶ȵĹ�ϵ���£�
2NH3����ƽ�ⳣ��K����ֵ���¶ȵĹ�ϵ���£�
�¶�/�� | 200 | 300 | 400 |
K | 1.00 | 0.86 | 0.50 |
�����ϱ����ݿ�֪�÷�Ӧ��H______0(�>����<��)��
��400��ʱ�����ijʱ��c(N2)��1 mol��L-1��c(H2)��3 mol��L-1��c(NH3)��2 mol��L-1����ʱ�̸÷�Ӧ��v��____v��(����>����=������<��)��
��4����ͼ���ܱշ�Ӧ���а�n(N2)��n(H2)��1��3Ͷ�Ϻ�ϳ�NH3����200�桢400�桢600���£���Ӧ�ﵽƽ��ʱ���������NH3�����ʵ���������ѹǿ�ı仯���ߡ�

������a��Ӧ���¶���__________________��
�ڹ��ںϳɰ��ķ�Ӧ������������ȷ����________��
A. ��ʱ�����NH3�������H2��ƽ��ת����
B. �Ӵ����ܼӿ췴Ӧ���������H2��ƽ��ת����
C. ͼ��M��Q��ƽ�ⳣ��K�Ĺ�ϵ��K(M)>K(Q)
��M���Ӧ��H2��ת������____________________��
��400��ʱ����1mol N2��3mol H2�����ѹ�ܱ������У���ͼ�ֱ�����ʱ�(��H)���������ƽ����Է�������(M)��N2��������[��(N2)]�ͻ�������ܶ�(��)�뷴Ӧʱ�䣨t���Ĺ�ϵ����ͼ��ȷ���ܱ����÷�Ӧ�ﵽƽ��״̬����_____________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ά���ཱུ֬ҩ�������ؿ�������X��һ�������·�Ӧ�Ƶã�(����)
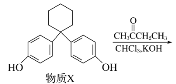
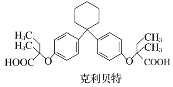
�����й�������ȷ����(����)
A. �������صķ���ʽΪC28H36O5
B. ����X����������̼ԭ�ӿ���λ��ͬһƽ����
C. 1 mol����X�������뺬2 mol Br2����ˮ��Ӧ
D. �ñ���NaHCO3��Һ���Լ�������X�Ϳ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.Һ������������������ǻ�ѧ��Ӧ
B.������ˮ�õ���ˮ������ֻ�������仯
C.����Һ̬������ȡ�������ڵ��Ĺ̶�
D.�����������������ɰ��������˹��̵�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������л�Ϊͬϵ�����( )
A. CH3��CH2��CH3��CH3��CH2��CH2��CH2��CH3B. CH3��CH3��CH3��CH![]() CH2
CH2
C. CH3��CH2��CH3��CH3��CH![]() CH2D. CH3��CH2��CH
CH2D. CH3��CH2��CH![]() CH2 ��CH3��CH2��CH2��CH3
CH2 ��CH3��CH2��CH2��CH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��¡����Ϊ2L���ܱ������м���1molCO2��3molH2���������µķ�Ӧ��CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) ��H��0�����϶��ÿ��淴Ӧ��һ���������Ѵﵽ��ѧƽ��״̬����( )
CH3OH(g) +H2O(g) ��H��0�����϶��ÿ��淴Ӧ��һ���������Ѵﵽ��ѧƽ��״̬����( )
A. ������CO2��H2��CH3OH��H2O�����ʵ���֮��Ϊ1��3��1 ��1B. v��(CO2)��v��(H2O)
C. �����ڻ�������ܶȱ��ֲ���D. 3molH��H������ͬʱ����3molH��O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ�������¿ɷ����ֽ⣺2H2O2(l��=2H2O(l��+O2(g�����������仯����ͼ��ʾ������˵����ȷ����

A���÷ֽⷴӦΪ���ȷ�Ӧ
B��2molH2O2���������2molH2O��1molO2�����������
C������MnO2��FeCl3������߸÷ֽⷴӦ������
D������������ͬʱ��H2O2��Һ��Ũ��Խ����ֽ�����Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2SO2(g) + O2(g) ![]() 2SO3(g)�ǹ�ҵ���������Ҫ��Ӧ֮һ��һ���¶��£��ڼס��ҡ��������ݻ���Ϊ2 L�ĺ����ܱ�������Ͷ��SO2(g)��O2(g)������ʼ���ʵ�����SO2��ƽ��ת�������±���ʾ�������ж��У���ȷ����
2SO3(g)�ǹ�ҵ���������Ҫ��Ӧ֮һ��һ���¶��£��ڼס��ҡ��������ݻ���Ϊ2 L�ĺ����ܱ�������Ͷ��SO2(g)��O2(g)������ʼ���ʵ�����SO2��ƽ��ת�������±���ʾ�������ж��У���ȷ����
�� | �� | �� | ||
��ʼ���ʵ��� | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
n(O2) / mol | 0.24 | 0.24 | 0.48 | |
SO2��ƽ��ת���� / % | 80 | ��1 | ��2 | |
A. ���з�Ӧ��ƽ�ⳣ��С����
B. ƽ��ʱ������c(SO3)�Ǽ��е�2��
C. ���¶��£�ƽ�ⳣ��ֵΪ400
D. ƽ��ʱ������O2��ת���ʴ�������O2��ת����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com