
【题目】液氨作为一种潜在的清洁汽车燃料已越来越被重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。
(1)氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) ΔH2
则4NH3(g)+3O2(g)=2N2(g)+6H2O(l)的ΔH=_____。(请用含有ΔH1、ΔH2的式子表示)
(2)氨气可以直接用于燃料电池,选择碱性溶液作为电解质溶液,写出负极的电极反应式__________。
(3)已知合成氨反应的方程式为N2+3H2![]() 2NH3,其平衡常数K的数值和温度的关系如下:
2NH3,其平衡常数K的数值和温度的关系如下:
温度/℃ | 200 | 300 | 400 |
K | 1.00 | 0.86 | 0.50 |
①由上表数据可知该反应ΔH______0(填“>”或“<”)。
②400℃时,测得某时刻c(N2)=1 mol·L-1、c(H2)=3 mol·L-1、c(NH3)=2 mol·L-1,此时刻该反应的v正____v逆(填“>”“=”或“<”)。
(4)下图是密闭反应器中按n(N2)∶n(H2)=1∶3投料后合成NH3,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。

①曲线a对应的温度是__________________。
②关于合成氨的反应,下列叙述正确的是________。
A. 及时分离出NH3可以提高H2的平衡转化率
B. 加催化剂能加快反应速率且提高H2的平衡转化率
C. 图中M、Q点平衡常数K的关系是K(M)>K(Q)
③M点对应的H2的转化率是____________________。
④400℃时,将1mol N2和3mol H2充入恒压密闭容器中,下图分别代表焓变(ΔH)、混合气体平均相对分子质量(M)、N2质量分数[φ(N2)]和混合气体密度(ρ)与反应时间(t)的关系,下图正确且能表明该反应达到平衡状态的是_____________________。

【答案】0.6△H1+0.4△H2 2NH3+6OH--6e-=N2+6H2O < > 200℃ A 75% BCD
【解析】
(1)根据盖斯定律计算反应热;
(2)氨气在负极失电子发生氧化反应,结合电子守恒、原子守恒书写电极反应式;
(3)①由图表数据分析,平衡常数随温度升高减小,说明升温平衡逆向进行;
②计算此时的浓度商和平衡常数比较判断反应进行的方向;
(4)①合成氨反应放热,温度越低氨气的百分含量越高;
②合成氨是气体体积减小的放热反应,结合平衡移动原理分析判断选项;
③结合三段式列式计算;
④根据可逆反应中变量不变反应达到平衡状态分析解答。
(1)已知:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) ΔH2
根据盖斯定律可知,(①×3+②×2)×1/5得到4NH3(g)+3O2(g)=2N2(g)+6H2O(l),则△H=0.6△H1+0.4△H2;
(2)由总反应4NH3+3O2=2N2+6H2O可知正极反应为O2+2H2O+4e-=4OH-,由电子守恒和电荷守恒可知,负极是氨气失电子发生氧化反应,电极反应式为2NH3+6OH--6e-=N2+6H2O;
(3)①图表数据分析,平衡常数随温度升高减小,说明升温平衡逆向进行,逆反应为吸热反应,正反应为放热反应,△H<0;
②400℃时,测得某时刻c(N2)=1 mol·L-1、c(H2)=3 mol·L-1、c(NH3)=2 mol·L-1,浓度商Qc=![]() <K=0.5,反应向正反应方向进行,此时刻该反应的v正>v逆;
<K=0.5,反应向正反应方向进行,此时刻该反应的v正>v逆;
(4)①合成氨反应放热,温度越低氨气的百分含量越高,所以曲线a对应的温度是200℃;
②A.及时分离出NH3平衡正向进行,可以提高H2的平衡转化率,故A正确;
B.加催化剂能加快反应速率,不改变化学平衡,不能提高H2的平衡转化率,故B错误;
C.图中M、Q点温度相同,平衡常数只与温度有关系,图中M、Q点平衡常数K的关系是K(M)=K(Q),故C错误;
故答案为A;
③设反应的氮气物质的量为xmol,则
N2+3H2![]() 2NH3
2NH3
起始量(mol) 1 3 0
转化量(mol) x 3x 2x
平衡量(mol)1-x 3-3x 2x
据题意M点时:2x/(4-2x)=0.6
解得x=0.75
则氢气的转化率为:3×0.75mol÷3mol×100%=75%;
④400℃时,将1mol N2和3mol H2充入恒压密闭容器中,焓变(△H)始终不变,混合气体平均相对分子质量(![]() )为变量、N2体积分数φ(N2)为变量,气体密度(ρ)为变量,随反应进行,气体的物质的量减小,则
)为变量、N2体积分数φ(N2)为变量,气体密度(ρ)为变量,随反应进行,气体的物质的量减小,则![]() 随时间增大而增大,直到达到平衡状态不变;N2体积分数逐渐减小,到达到平衡状态不变,达到平衡状态时体积不变,密度不变,由图可知,正确且能表明该可逆反应达到平衡状态的为BCD。
随时间增大而增大,直到达到平衡状态不变;N2体积分数逐渐减小,到达到平衡状态不变,达到平衡状态时体积不变,密度不变,由图可知,正确且能表明该可逆反应达到平衡状态的为BCD。


科目:高中化学 来源: 题型:
【题目】无水FeCl3呈棕红色,极易潮解, 100 ℃ 左右时升华,工业上常用作有机合成催化剂。实验室可用下列装置(夹持仪器略去)制备并收集无水FeCl3。
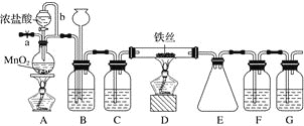
(1)装置A中反应的离子方程式为____________________________________________。
(2)装置F中所加的试剂为________。
(3)导管b的作用为________________________________________________________;
装置B的作用为__________________________________________________________。
(4)实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯,原因为__________。
(5)反应结束后,拆卸装置前,必须进行的操作是______________________。
(6)为检验所得产品为FeCl3,可进行如下实验:取E中收集的产物少许,加水溶解,向所得溶液中加入
________________________(填试剂名称和现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有平衡体系CO(g)+2H2(g)====CH3OH(g) ΔH<0,为增加甲醇的产量,应采取的正确措施是( )
A.高温、高压B.适宜的温度、高压、催化剂
C.低温、低压D.高温、高压、催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B是核电荷数为1~18中的元素,在自然界中含量A要多于B,它们的原子电子层结构均具有核外电子总数是电子层数的4倍的特点,回答下列问题:
(1)A、B的元素符号分别是 A______、B_______
(2)画出B离子结构示意图:_____
(3)由A和B元素组成的物质_____(填“属于”或“不属于”)电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列判断正确的是
A. 标准状况下,2.8 g 14C18O中质子数为1.4NA
B. 常温下,0.3 mol NO2通入水中完全反应,转移的电子数为0.2NA
C. CO燃烧热为283.0 kJ/mol,若一定量的CO完全燃烧放出热量为283.0 kJ,则消耗O2分子数为NA
D. 62.0 g乙二醇中含有的羟基数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如下左图,电池的工作原理如下右图。下列有关说法正确的是
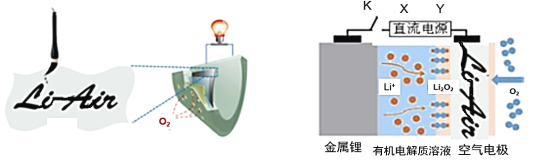
A. 放电时,纸张中的纤维素作为锂电池的负极
B. 充电时,若阳极放出1 mol O2,则有4 mol e-回到电源正极
C. 开关K闭合给锂电池充电,X为直流电源负极
D. 放电时,Li+由正极经过有机电解质溶液移向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。粗盐中含Ca2+、Mg2+、SO42-以及泥沙等杂质,为了除去可溶性杂质,有以下实验步骤进行提纯:
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。
(1)以下操作顺序不合理的是 _______。
A.②⑤④③① B.④⑤②①③ C.⑤②④①③ D.⑤④②①③
(2)用提纯的NaCl配制450 mL 4.00 mol·L-1NaCl溶液,所用仪器除天平、药匙、烧杯、玻璃棒外还有________(填仪器名称)。
(3)通过步骤①中过滤后的滤液,检验SO42-是否除尽的操作方法是_________________________
Ⅱ.向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。回答下列问题:

(1)图1中通入CO2后所得溶液的溶质成分为____________________;
(2)图3中通入CO2后所得溶液的溶质成分为____________________。
Ⅲ.已知氮化镁极易与水反应:Mg3N2+6H2O===2NH3↑+3Mg(OH)2↓。将足量的镁条置于空气燃烧,可能会发生下列反应①2Mg+O2![]() 2MgO;②3Mg+N2
2MgO;②3Mg+N2![]() Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2![]() 2MgO+C;④Mg+H2O(g)
2MgO+C;④Mg+H2O(g)![]() MgO+H2。请设计一个实验,验证产物中含有氮化镁(Mg3N2):_________________________。
MgO+H2。请设计一个实验,验证产物中含有氮化镁(Mg3N2):_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨九种元素,填写下列空白:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
一 | ① | |||||||
二 | ② | ③ | ④ | |||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
四 | ⑨ |
(1)在这些元素中,金属性最强的是________(填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是________。
(3)最高价氧化物是两性氧化物的元素是________;写出它的氧化物与氢氧化钠反应的离子方程式___________________________________________________________。
(4)③④⑤对应的简单离子半径由小到大的顺序为:______________。
(5)①与③可形成一种18 e- 的分子,写出该分子的电子式:__________,该分子中存在________(填“极性键”或“非极性键”或“离子键”)。
(6)①与⑤形成的化合物可与水反应生成一种无色气体,当转移0.5mol电子时,生成的气体在标准状况下的体积为______L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com