
����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��еĢ١������Ԫ�أ���д���пհף�
�� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0�� |
һ | �� | |||||||
�� | �� | �� | �� | |||||
�� | �� | �� | �� | �� | ||||
�� | �� |
(1)����ЩԪ���У���������ǿ����________(�����Ԫ�ط��ţ���ͬ)��
(2)������������ˮ�����У�������ǿ�Ļ�����Ļ�ѧʽ��________��
(3)����������������������Ԫ����________��д���������������������Ʒ�Ӧ�����ӷ���ʽ___________________________________________________________��
(4)�ۢܢݶ�Ӧ�ļ����Ӱ뾶��С�����˳��Ϊ��______________��
(5)����ۿ��γ�һ��18 e- �ķ��ӣ�д���÷��ӵĵ���ʽ��__________���÷����д���________(�������Լ��������Ǽ��Լ����������Ӽ���)��
(6)������γɵĻ��������ˮ��Ӧ����һ����ɫ���壬��ת��0.5mol����ʱ�����ɵ������ڱ�״���µ����Ϊ______L��
���𰸡�K HClO4 Al Al2O3+2OH-= 2AlO2-+H2O Na+ <O2-< N3- ![]() ���Լ����Ǽ��Լ� 11.2
���Լ����Ǽ��Լ� 11.2
��������
����Ԫ�������ڱ��е�λ�ù�ϵ��֪���٢ڢۢܢݢޢߢ��ֱ���H��C��N��O��Na��Al��S��Cl��K��������ʽṹ����������
(1)ͬ������Ԫ�ؽ����Դ��������μ�����ͬ������Ԫ�ؽ����Դ��ϵ�����������������ЩԪ���У���������ǿ����K��
(2)�ǽ�����Խǿ��Ԫ������������ˮ���������Խ����ͬ������Ԫ�طǽ����Դ�����������ǿ��ͬ������Ԫ�طǽ����Դ��ϵ������μ�������Ԫ������������ˮ����������ǿ�Ļ�����Ļ�ѧʽ��HClO4��
(3)������Ϊ���������������������������������Ԫ����Al�����������������Ʒ�Ӧ����ƫ�����ƺ�ˮ�������ӷ���ʽΪAl2O3+2OH-= 2AlO2-+H2O��
(4)���Ӳ���Խ�����Ӱ뾶Խ���Ӳ�����ͬʱ��ԭ�ӵĺ˵����Խ�٣���Ӧ�ļ����Ӱ뾶Խ����ۢܢݶ�Ӧ�ļ����Ӱ뾶��С�����˳��Ϊ��Na+ <O2- <N3-��
(5)����ۿ��γ�һ��18e-�ķ���ΪN2H4���÷����ڸ�ԭ�������ȶ�״̬�������ʽΪ![]() ���÷����д���N��N֮����ڷǼ��Լ���N��H֮����ڼ��Լ����ʴ�Ϊ��
���÷����д���N��N֮����ڷǼ��Լ���N��H֮����ڼ��Լ����ʴ�Ϊ��![]() �����Լ����Ǽ��Լ���
�����Լ����Ǽ��Լ���
(6)������γɵĻ�����ΪNaH����ˮ��Ӧ�����������仯ѧ����ʽΪ��NaH+H2O=NaOH+H2�������ݹ�ϵʽH2![]() e-��֪����ת��0.5mol����ʱ�����ɵ������ڱ�״���µ����Ϊ0.5mol��22.4L/mol=11.2L��
e-��֪����ת��0.5mol����ʱ�����ɵ������ڱ�״���µ����Ϊ0.5mol��22.4L/mol=11.2L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Һ����Ϊһ��DZ�ڵ��������ȼ����Խ��Խ�����ӡ����ڰ�ȫ�ԡ��۸�ȷ���ϻ�ʯȼ�Ϻ���ȼ�����Žϴ�����ơ�
��1������ȼ��ʵ���漰����������صķ�Ӧ��
��4NH3(g)+5O2(g)��4NO(g)+6H2O(l) ��H1
��4NH3(g)+6NO(g)��5N2(g)+6H2O(l) ��H2
��4NH3(g)+3O2(g)��2N2(g)+6H2O(l)�Ħ�H��_____��(���ú��Ц�H1����H2��ʽ�ӱ�ʾ)
��2����������ֱ������ȼ�ϵ�أ�ѡ�������Һ��Ϊ�������Һ��д�������ĵ缫��Ӧʽ__________��
��3����֪�ϳɰ���Ӧ�ķ���ʽΪN2+3H2![]() 2NH3����ƽ�ⳣ��K����ֵ���¶ȵĹ�ϵ���£�
2NH3����ƽ�ⳣ��K����ֵ���¶ȵĹ�ϵ���£�
�¶�/�� | 200 | 300 | 400 |
K | 1.00 | 0.86 | 0.50 |
�����ϱ����ݿ�֪�÷�Ӧ��H______0(�>����<��)��
��400��ʱ�����ijʱ��c(N2)��1 mol��L-1��c(H2)��3 mol��L-1��c(NH3)��2 mol��L-1����ʱ�̸÷�Ӧ��v��____v��(����>����=������<��)��
��4����ͼ���ܱշ�Ӧ���а�n(N2)��n(H2)��1��3Ͷ�Ϻ�ϳ�NH3����200�桢400�桢600���£���Ӧ�ﵽƽ��ʱ���������NH3�����ʵ���������ѹǿ�ı仯���ߡ�

������a��Ӧ���¶���__________________��
�ڹ��ںϳɰ��ķ�Ӧ������������ȷ����________��
A. ��ʱ�����NH3�������H2��ƽ��ת����
B. �Ӵ����ܼӿ췴Ӧ���������H2��ƽ��ת����
C. ͼ��M��Q��ƽ�ⳣ��K�Ĺ�ϵ��K(M)>K(Q)
��M���Ӧ��H2��ת������____________________��
��400��ʱ����1mol N2��3mol H2�����ѹ�ܱ������У���ͼ�ֱ�����ʱ�(��H)���������ƽ����Է�������(M)��N2��������[��(N2)]�ͻ�������ܶ�(��)�뷴Ӧʱ�䣨t���Ĺ�ϵ����ͼ��ȷ���ܱ����÷�Ӧ�ﵽƽ��״̬����_____________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��¡����Ϊ2L���ܱ������м���1molCO2��3molH2���������µķ�Ӧ��CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) ��H��0�����϶��ÿ��淴Ӧ��һ���������Ѵﵽ��ѧƽ��״̬����( )
CH3OH(g) +H2O(g) ��H��0�����϶��ÿ��淴Ӧ��һ���������Ѵﵽ��ѧƽ��״̬����( )
A. ������CO2��H2��CH3OH��H2O�����ʵ���֮��Ϊ1��3��1 ��1B. v��(CO2)��v��(H2O)
C. �����ڻ�������ܶȱ��ֲ���D. 3molH��H������ͬʱ����3molH��O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ�������¿ɷ����ֽ⣺2H2O2(l��=2H2O(l��+O2(g�����������仯����ͼ��ʾ������˵����ȷ����

A���÷ֽⷴӦΪ���ȷ�Ӧ
B��2molH2O2���������2molH2O��1molO2�����������
C������MnO2��FeCl3������߸÷ֽⷴӦ������
D������������ͬʱ��H2O2��Һ��Ũ��Խ����ֽ�����Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ��̶���VL�ܱ������г���4molNH3��5molO2���������·�Ӧ��4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g)����ش��������⣺
4NO(g)+6H2O(g)����ش��������⣺
(1)������˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����_______��
A ��������������������
B c(O2)����
C v(O2)��1.25v(NH3)
D ��ϵѹǿ����
E ��ͬʱ���ڣ�����0.1 mol NH3��ͬʱ������0.1 mol NO
(2)����Ӧ�ھ����ܱ�ϵͳ�н���ʱ�������������䣬��Ӧ��������������С������������������Ϊ______����������С��ԭ����_____��
(3)1mol NH3(g)�ڴ�������ȫȼ����������Ⱦ����̬���ʣ��ų�akJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ__________________________________________��
(4)����(3)������Ӧ���Ϊ�������ҺΪKOH��ԭ��أ�����Ӧʽ _________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У����÷�Һ©�����з������
A.����CCl4B.���CCl4C.�ƾ���ˮD.���ͺ�ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ�ṩ����Ϣ���������ý��۲���ȷ����
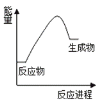
A. �÷�Ӧ�����ȷ�Ӧ
B. ��Ϊ����������������ڷ�Ӧ��������������Ը÷�Ӧһ����Ҫ���Ȳ��ܷ���
C. �÷�Ӧ��Ӧ����Ѿɼ������յ����������������γ��¼��ų�������
D. �÷�Ӧ������̼��ƷֽⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2SO2(g) + O2(g) ![]() 2SO3(g)�ǹ�ҵ���������Ҫ��Ӧ֮һ��һ���¶��£��ڼס��ҡ��������ݻ���Ϊ2 L�ĺ����ܱ�������Ͷ��SO2(g)��O2(g)������ʼ���ʵ�����SO2��ƽ��ת�������±���ʾ�������ж��У���ȷ����
2SO3(g)�ǹ�ҵ���������Ҫ��Ӧ֮һ��һ���¶��£��ڼס��ҡ��������ݻ���Ϊ2 L�ĺ����ܱ�������Ͷ��SO2(g)��O2(g)������ʼ���ʵ�����SO2��ƽ��ת�������±���ʾ�������ж��У���ȷ����
�� | �� | �� | ||
��ʼ���ʵ��� | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
n(O2) / mol | 0.24 | 0.24 | 0.48 | |
SO2��ƽ��ת���� / % | 80 | ��1 | ��2 | |
A. ���з�Ӧ��ƽ�ⳣ��С����
B. ƽ��ʱ������c(SO3)�Ǽ��е�2��
C. ���¶��£�ƽ�ⳣ��ֵΪ400
D. ƽ��ʱ������O2��ת���ʴ�������O2��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(FeS2����������Ϊ60%)Ϊԭ���Ʊ��Ȼ�������(FeCl3��6H2O��270.5g��mo��1)�Ĺ���������ͼ��ʾ��

��ش��������⣺
��1��Ϊ�ӿ챺�շ�Ӧ�Ļ�ѧ��Ӧ���ʣ��ɲ�ȡ�Ĵ�ʩΪ_____��_____��(��д����)
��2�����պ�õ���Fe2O3�����ܹ����з�����Ӧ�����ӷ���ʽΪ________��
��3�����˲����õ��IJ����������ձ���_______��______��
��4�����չ����в�����SO2���ù����İ�ˮ�������գ�������Һ�����ʵ�����Ϊ_______��
��5�������Ȼ�����Һ�м����������Ŀ����______����______��______�����ˡ�ϴ�ӣ����յõ��Ȼ������塣
��6����ȡ1kg��������������(��Ԫ����������������ʧ��Ϊ4%)����ɵ��Ȼ������������Ϊ_______(����һλС��)kg��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com