
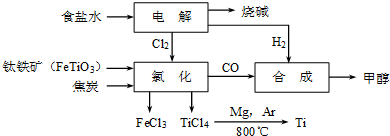
��ұ�������ȼ���״������һ����ҵ������ͼ��ʾ��������������Դ�������ʣ����ٻ�����Ⱦ��

��ش��������⣺
��1��Ti��ԭ������Ϊ22��Tiλ��Ԫ�����ڱ��е�_______���ڣ���______�塣
��2��д���������ڸ������뽹̿���Ȼ��õ����Ȼ��ѵĻ�ѧ����ʽ ��
��3���Ʊ�TiO2�ķ���֮һ������TiCl4ˮ������TiO2��x H2O���پ������Ƶá�ˮ��ʱ����������ˮ�����ȣ����ϻ�ѧ����ʽ�ͱ�Ҫ������˵��ԭ��
��4����TiCl4��Ti ��Ҫ��Ar���н��е�������________________________________����Ӧ��õ�Mg��MgCl2��Ti�Ļ����ɲ����������ķ�������õ�Ti�������±���Ϣ������ȵ��¶��Ը��� �漴�ɡ�
|
|
TiCl4 |
Mg |
MgCl2 |
Ti |
|
�۵�/�� |
��25.0 |
648.8 |
714 |
1667 |
|
�е�/�� |
136.4 |
1090 |
1412 |
3287 |
��5����������ԭ�ζ����ⶨTiO2������������һ�������£���TiO2�ܽⲢ��ԭΪTi3+ ������KSCN��Һ��ָʾ������NH4Fe(SO4)2����Һ�ζ�Ti3+��ȫ������Ti4+���ζ�����ʱ����ȡTiO2��Ħ������ΪM g/mol������w g������c mol/L NH4Fe(SO4)2����ҺV mL����TiO2��������Ϊ___________________�����ô���ʽ��ʾ��
��6����CO��H2�ϳɼ״��ķ���ʽ�ǣ�CO(g)��2H2(g) CH3OH(g)���������������� �������ʵ��κ���ʧ��������ҵ����ÿ�ϳ�6mol�״�����������ⲹ��H2 mol��
CH3OH(g)���������������� �������ʵ��κ���ʧ��������ҵ����ÿ�ϳ�6mol�״�����������ⲹ��H2 mol��
��1����;��B����1�֣� ��2��2FeTiO3��6C��7Cl2���� 2FeCl3��2TiCl4��6CO ��3��TiCl4+(2+x) H2O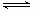 TiO2��xH2O+4HCl���������ˮ�����ȣ��ٽ�ˮ��������ȫ�����ʹˮ��������У�4����ֹ�ѡ�þ�����������ֹ��þ�������ˮ��Ӧ�� ��5��
TiO2��xH2O+4HCl���������ˮ�����ȣ��ٽ�ˮ��������ȫ�����ʹˮ��������У�4����ֹ�ѡ�þ�����������ֹ��þ�������ˮ��Ӧ�� ��5��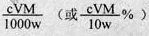 ��6��5
��6��5
��������
�����������1��Tiλ��Ԫ�����ڱ��е������ڣ��ڢ�B�塣��2�����ݷ�Ӧ��Ͳ������д���������ڸ������뽹̿���Ȼ��õ����Ȼ��ѵĻ�ѧ����ʽ2FeTiO3��6C��7Cl2���� 2FeCl3��2TiCl4��6CO����3���Ʊ�TiO2�ķ���֮һ������TiCl4ˮ������TiO2•x H2O���پ������Ƶá�TiCl4+(2+x) H2O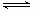 TiO2��xH2O+4HCl���������ˮ�����ȣ��ٽ�ˮ��������ȫ����4��Mg�ǻ��ý�������������ж������ʷ�Ӧ����˿ɵó�Ar������Ϊ����������ֹMg�Ϳ��������ʷ�Ӧ����5�����ݵ�ʧ�����غ㣬�У�1Ti3+��1Fe3+����n��Fe3+��=n��Ti3+��=n��TiO2��=cV��10-3mol������������ΪΪ��
TiO2��xH2O+4HCl���������ˮ�����ȣ��ٽ�ˮ��������ȫ����4��Mg�ǻ��ý�������������ж������ʷ�Ӧ����˿ɵó�Ar������Ϊ����������ֹMg�Ϳ��������ʷ�Ӧ����5�����ݵ�ʧ�����غ㣬�У�1Ti3+��1Fe3+����n��Fe3+��=n��Ti3+��=n��TiO2��=cV��10-3mol������������ΪΪ��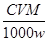 ����6����CO��H2�ϳɼ״��ķ���ʽ�ǣ�CO(g)��2H2(g)
����6����CO��H2�ϳɼ״��ķ���ʽ�ǣ�CO(g)��2H2(g) CH3OH(g)���������������� �������ʵ��κ���ʧ��������ҵ����ÿ�ϳ�6mol�״�����������ⲹ��H2
5mol��
CH3OH(g)���������������� �������ʵ��κ���ʧ��������ҵ����ÿ�ϳ�6mol�״�����������ⲹ��H2
5mol��
���㣺�����Թ�ҵ��������Ϊ�������ϵ���Ϣ�⣬�����˻�ѧ�������ۺͻ���֪ʶ�����ͱȽ�
��ӱ�����е��Ѷȣ���������������ͨ����ij����Ҫ������Ʒ�Ĺ�ҵ�������̼�ͼ����������Ӧ�û�ѧ��Ӧԭ������ѧƽ��ԭ����ˮ�����ۡ������Ʊ��ͷ����֪ʶ����ɫ��ѧ�Լ��Ծ��õ��ӽǷ���ʵ�������еĸ��������������������������Ҫ���յļ����ǣ����ȫ�⣬ȷ�������̵�Ŀ�ģ�������������ͼ���˽�����ͼ���������������������Ϣ�����������е���ʾ����Ϣ��������һ�������ͽ�������ʱ������ϵ�͵��á�


 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��
��
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| TiCl4 | Mg | MgCl2 | Ti | |
| �۵�/�� | -25.0 | 648.8 | 714 | 1667 |
| �е�/�� | 136.4 | 1090 | 1412 | 3287 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��ɽ��ʡ�����и�����ѧ����ĩģ�⻯ѧ�Ծ��������棩 ���ͣ������
��12�֣���ұ�������ȼ���״������һ����ҵ������ͼ��ʾ��������������Դ�������ʣ����ٻ�����Ⱦ��

��ش��������⣺
��1��Ti��ԭ������Ϊ22��Tiλ��Ԫ�����ڱ��е�_______���ڣ���______�塣
��2��д���������ڸ������뽹̿���Ȼ��õ����Ȼ��ѵĻ�ѧ����ʽ ��
��3���Ʊ�TiO2�ķ���֮һ������TiCl4ˮ������TiO2��x H2O���پ������Ƶá�ˮ��ʱ����������ˮ�����ȣ����ϻ�ѧ����ʽ�ͱ�Ҫ������˵��ԭ��
��4����TiCl4��Ti ��Ҫ��Ar���н��е�������_________________________________����Ӧ��õ�Mg��MgCl2��Ti�Ļ����ɲ����������ķ�������õ�Ti�������±���Ϣ������ȵ��¶��Ը��� �漴�ɡ�
|
|
TiCl4 |
Mg |
MgCl2 |
Ti |
|
�۵�/�� |
��25.0 |
648.8 |
714 |
1667 |
|
�е�/�� |
136.4 |
1090 |
1412 |
3287 |
��5����������ԭ�ζ����ⶨTiO2������������һ�������£���TiO2�ܽⲢ��ԭΪTi3+������KSCN��Һ��ָʾ������NH4Fe(SO4)2����Һ�ζ�Ti3+��ȫ������Ti4+���ζ�����ʱ����ȡTiO2��Ħ������ΪM g/mol������w g������c mol/L NH4Fe(SO4)2����ҺV mL����TiO2��������Ϊ___________________�����ô���ʽ��ʾ��
��6����CO��H2�ϳɼ״��ķ���ʽ�ǣ�CO(g)��2H2(g) CH3OH(g)���������������� �������ʵ��κ���ʧ��������ҵ����ÿ�ϳ�6mol�״�����������ⲹ��H2 mol��
CH3OH(g)���������������� �������ʵ��κ���ʧ��������ҵ����ÿ�ϳ�6mol�״�����������ⲹ��H2 mol��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com