
【题目】元素周期表中前七周期所含的元素种数如下表:
周期 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
元素种数 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
由此推测第八周期最多可能含有的元素种数是( )。
A.18 B.32 C.50 D.64
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】100 mL H2、C2H6和CO2的混合气体与300 mL O2混合点燃,经充分反应并干燥后,总体积减少100 mL。再将剩余气体通过碱石灰吸收,体积又减少100 mL。上述体积均在同温同压下测定。求原混合气体中各组分的体积。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向 1L 0.10 mol·L-1CH3COONa 溶液中,不断通入HC1气体(忽略溶液体积变化),得到 c (CH3COO-)和c(CH3COOH)与 pH 的变化关系如下,则下列说法正确的是
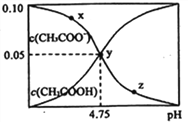
A. 溶液的pH比较:x<y <z
B. 在y点再通入0.05 mol HCl气体,溶液中离子浓度大小比较:c(Na+) =c(Cl-) > c(H+) >c(CH3COO-) >c(OH-)
C. 在溶液中加入一滴强酸或强碱,溶液pH变化最小的是y点
D. 该温度下,CH3COOH的Ka=104.75
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。
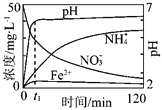
(1)实验前:①先用0.1 mol·L-1H2SO4洗涤Fe粉,其目的是_________,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入________(写化学式)。
(2)图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式 _____________ 。
(3)该课题组对影响脱氮速率的因素提出了如下假设,请你完成假设二和假设三
假设一:溶液的pH;假设二:__________________; 假设三:__________________;
(4)请你设计实验验证上述假设一,写出实验步骤及结论。(已知:溶液中的NO![]() 浓度可用离子色谱仪测定)__________________
浓度可用离子色谱仪测定)__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东汉《周易参同契》中记载:“胡粉投火中,色坏还为铅”,实验表明胡粉难溶于水,加强热产生能使澄清的石灰水浑浊的湿气.胡粉的主要成分
A. PbCO3 B. SnCO3Sn(OH)2 C. 2PbCO3Pb(OH)2 D. (CH3COO)2Pb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,请回答下列问题:
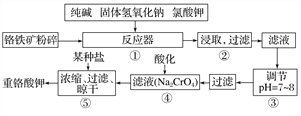
(1)以上工艺流程所涉及元素中属于过渡元素的有________,铁在周期表中的位置是第______周期______族。
(2)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:_________________。
(3)NaFeO2能发生强烈水解,在步骤②中生成沉淀而除去,写出该反应的化学方程式:_________________。
(4)流程④中酸化所用的酸和流程⑤中所用的某种盐最合适的是____________(填字母)。
A.盐酸和氯化钾 B.硫酸和氯化钾 C.硫酸和硫酸锌 D.次氯酸和次氯酸钾
酸化时,CrO![]() 转化为Cr2O
转化为Cr2O![]() ,写出平衡转化的离子方程式:________________。
,写出平衡转化的离子方程式:________________。
(5)水溶液中的H+是以H3O+的形式存在,H3O+的电子式为_____________。
(6)简要叙述操作③的目的:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】借助碱金属和卤族元素的递变性分析下面的推断,其中正确的是( )
A.已知Ca是第4周期、第ⅡA族的元素,故Ca(OH)2的碱性比Mg(OH)2的碱性弱
B.已知As是第4周期、第ⅤA族的元素,故AsH3的稳定性比NH3的稳定性强
C.已知Cs的原子半径比Na的原子半径大,故Cs与水反应不如Na与水反应剧烈
D.已知Cl的核电荷数比F的核电荷数大,故Cl的原子半径比F的原子半径大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室模拟工业上以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验
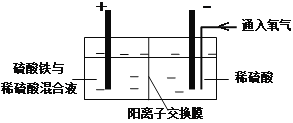
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相)![]() R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
① 阳极区硫酸铁的主要作用是 _____________。
② 电解过程中,阳极区Fe3+的浓度基本保持不变,原因是_____________。(使用化学用语作答)
(2)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 _____________;加入有机萃取剂的目的是___________________。
(3)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 _____________。
(4)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 ___________________。(忽略电解前后溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】称取两份铝粉,第一份加足量的NaOH溶液,第二份加足量的盐酸,若放出等量的气体,则两份铝粉的质量比为
A、1:1 B、2:3 C、1:2 D、1:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com