
【题目】100 mL H2、C2H6和CO2的混合气体与300 mL O2混合点燃,经充分反应并干燥后,总体积减少100 mL。再将剩余气体通过碱石灰吸收,体积又减少100 mL。上述体积均在同温同压下测定。求原混合气体中各组分的体积。
【答案】混和气体中H2 25mL,C2H6 25mL,CO2 50mL。
【解析】
试题分析:令H2、C2H6的体积分别为x mL、y mL,则:
2H2+O2![]() 2H2O 体积减少△V
2H2O 体积减少△V
2 1 3
xmL 0.5xmL 1.5x mL
C2H6+![]() O2
O2![]() 2CO2+3H2O体积减少△V
2CO2+3H2O体积减少△V
1 3.5 2 3 2.5
ymL 3.5y mL 2y mL 2.5y mL
由燃烧体积减少量,可得:1.5x+2.5y=100,由燃烧二氧化碳的体积,可得:100-x-y+2y=100,联立方程,解得:x=y=25,故原混合气体中二氧化碳体积为100mL-25mL-25mL=50mL,答:原混合气体中H2为25mL,C2H6为25mL,CO2为50mL。


科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水。某小组在实验室中探究ClO2与Na2S的反应。回答下列问题:
(l)ClO2的制备:(已知:SO2+2NaClO3+H2SO4=2ClO2↑+2NaHSO4)

①装置A中反应的化学方程式为_______________。
②欲收集干燥的ClO2,选择上图中的装置,其连接顺序为 a→_________(按气流方向,用小写字母表示)
③装置D的作用是_________。
(2)ClO2与 Na2S 的反应
将上述收集到的ClO2用 N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入上图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究 I 中反应的产物。
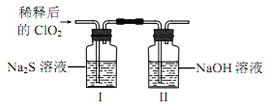
操作步骤 | 实验现象 | 结论 |
取少量Ⅰ中溶液于试管甲中, 加入Ba(OH)2溶液,振荡 | ①_________ | 有硫酸根离子生成 |
另取少量Ⅰ中溶液于试管乙中, 滴加品红溶液和盐酸 | 品红溶液不翅色 | ② 无_____生成 |
若在试管甲中继续加Ba(OH)2溶液至 过量,静置,取上层清液于试管丙③______ | 有白色沉淀生成 | 有Cl-生成 |
④ClO2与Na2S反应的离子方程式为__________。用于处理含硫废水时,ClO2相对于Cl2的优点是____________(任写2条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是常规核裂变产物之一,可以通过测定大气或水中
是常规核裂变产物之一,可以通过测定大气或水中![]() 的含量变化来监测核电站是否发生放射性物质泄漏。下列有关
的含量变化来监测核电站是否发生放射性物质泄漏。下列有关![]() 的叙述中错误的是
的叙述中错误的是
A. ![]() 的化学性质与
的化学性质与![]() 相同 B.
相同 B. ![]() 的原子序数为53
的原子序数为53
C. ![]() 的原子核外电子数为78 D.
的原子核外电子数为78 D. ![]() 的原子核内中子数多于质子数
的原子核内中子数多于质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药是我国四大发明之一,黑火药爆炸反应为:2KNO3+S+3C=K2S+N2↑+3CO2↑其中作为氧化剂的是
A. KNO3 B. C C. KNO3和S D. KNO3 和C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等, A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1)E的元素符号为__________,E、F的离子半径最小的是____(填离子符号);
(2)A、C、D三种元素组成的一种常见化合物,是氯碱工业的重要的产品,该化合物电子式为__________。
(3)B、C最简单的氢化物的稳定性最强的是__________(填分子式)。
(4)B与F两种元素形成的一种化合物分子,各原子均达8电子结构,则该化合物化学式为___________。B和F两种元素还能形成另一种化合物,其中B显最高正价,该化合物能与水反应生成两种酸,请写出该化合物与水反应的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
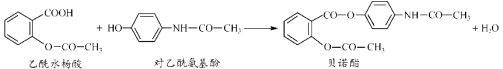
下列有关叙述正确的是
A.可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
B.贝诺酯分子中有三种含氧官能团
C.乙酰水杨酸和对乙酰氨基酚均能与Na2CO3 溶液反应
D.贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中前七周期所含的元素种数如下表:
周期 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
元素种数 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
由此推测第八周期最多可能含有的元素种数是( )。
A.18 B.32 C.50 D.64
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com