
| ||
| △ |
| ||
| ||
| △ |
| 149g×9.6g |
| 96g |
| 14.9g |
| 2 |
| 7.45g |
| 74.5g/mol |
| 0.4mol×1+0.4mol×1 |
| 2 |
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、Na和O2 |
| B、NaOH和CO2 |
| C、NaAlO2和盐酸 |
| D、AlCl3和氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
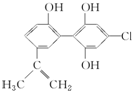 禁止运动员使用兴奋剂是保证比赛公平、公正的重要举措之一.其中一种兴奋剂X的结构如图所示.下列说法不正确的是( )
禁止运动员使用兴奋剂是保证比赛公平、公正的重要举措之一.其中一种兴奋剂X的结构如图所示.下列说法不正确的是( )| A、1 mol X与足量NaOH溶液反应,最多消耗3 mol NaOH |
| B、1 mol X与足量浓溴水反应,最多消耗4 mol Br2 |
| C、X遇FeCl3溶液显色,可看作酚类物质 |
| D、兴奋剂X所有碳原子有可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
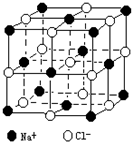 随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高.现有一种简单可行的测定方法,具体步骤为:
随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高.现有一种简单可行的测定方法,具体步骤为:查看答案和解析>>
科目:高中化学 来源: 题型:
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶解 |
| ① |
| ② |
| ③ |
| 过滤 |
| ④ |
| 适量盐酸 |
| ⑤ |
| 蒸发﹑结晶﹑烘干 |
| ⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com