
【题目】常温下,将![]() 缓慢通入水中至饱和,然后向其中滴加
缓慢通入水中至饱和,然后向其中滴加![]() 溶液。整个实验过程中溶液的pH变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是
溶液。整个实验过程中溶液的pH变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是![]()
![]()
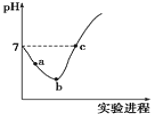
A.![]() 段,溶液中
段,溶液中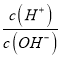 减小
减小
B.c点对应溶液中:![]()
C.b点对应溶液中:![]()
D.实验过程中用pH试纸测定溶液的pH
科目:高中化学 来源: 题型:
【题目】第VA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如下图所示,下列关于RCl5分子的说法中正确的是

A.每个原子都达到8电子稳定结构
B.分子中5个R-Cl键键能相同
C.键角(Cl-R-Cl)有90°、120°、180°几种
D.RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语的表述正确的( )
A. 醋酸的电离方程式:CH3COOH= CH3COO-+H+
B. H216O、H218O互为同位素
C. 质子数为53,中子数为78的碘原子:13153I
D. 氯离子的结构示意图:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 0.1 mol Fe在0.1 mol氯气中充分燃烧时转移的电子数为0.3NA
B. 0.1 mol乙烷和丙烯的混合物所含氢原子数目为0.6NA
C. 64 g的SO2与足量的O2充分反应后可得到NA个SO3分子
D. 标准状况下,2.24 L四氯化碳含有的分子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是__(填元素符号),e的价层电子轨道示意图为__ 。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为___;分子中既含有极性共价键,又含有非极性共价键的化合物是___(填化学式,写两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是__;酸根呈三角锥结构的酸是___。(填化学式)
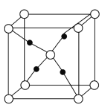
(4)e和c形成的一种离子化合物的晶体结构如图,则e离子的电荷为__。
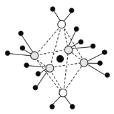
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图所示)。该化合物中阴离子为__,阳离子中存在的化学键类型有__;该化合物加热时首先失去的组分是__,判断理由是___。
(6)用晶体的X—射线衍射法对e的测定得到以下结果:e的晶胞为面心立方最密堆积(如下图),已知该晶体的密度为9.00g·cm-3,晶胞中该原子的配位数为________;e的原子半径为________cm(阿伏加德罗常数为NA,要求列式,下同)。晶胞中原子的体积占晶胞体积的百分率为__________。
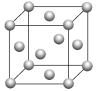
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体中可能合有Na+、K+、NH4+、Fe2+、Fe3+、 Cl-、SO42-、CO32-、HCO3-,将其配成100mL溶液。学生研究性学习小组为了确认其成分,设计并完成了如图所示实验:

请回答下列问题:
(1)配制100mL该溶液的过程中,“定容”操作正确的是________________。
A.  B.
B.  C.
C.  D.
D.
通过鉴定,该固体中一定存在的阳离子是_____________,一定不存在的阴离子是_____________。可能存在的离子是______________。实验过程生成气体的反应离子方程式为___________________
(2)下列实验结论符合事实的是_____________。
A.该固体中可能含有(NH4)2SO4、K2SO4、NaCl
B.该固体中可能含有(NH4)2SO4、KCl,一定不含NH4Cl
C.该固体中一定含有NH4Cl、K2SO4
D.该固体中可能含有(NH4)2SO4、KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活息息相关,下列叙述正确的是
A.次氯酸钠溶液作消毒剂,是因为钠盐能使蛋白质变性
B.工业电解熔融氧化铝冶炼铝,是因为氧化铝的成本比氯化铝低
C.生活中常用铁酱油、AD钙奶和钠盐,是因为铁、钙、碘都是人体必需元素
D.用硫化钠除去废水中的![]() 、
、![]() ,是因为硫化钠溶液是碱性,易生成氢氧化物沉淀
,是因为硫化钠溶液是碱性,易生成氢氧化物沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快 ②NO(g)+NOBr2(g)
NOBr2(g) 快 ②NO(g)+NOBr2(g)![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 正反应的活化能比逆反应的活化能小a kJ·mol-1
D. 增大Br2(g)浓度能增大活化分子百分数, 加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据下列能量变化示意图,请写出![]() 和CO反应的热化学方程式______。
和CO反应的热化学方程式______。

(2)在固定体积的密闭容器中,进行如下化学反应: ![]()
![]() H<0,其平衡常数K与温度T的关系如下表:
H<0,其平衡常数K与温度T的关系如下表:
T/K | 298 | 398 | 498 |
平衡常数K |
|
|
|
①试判断![]() ______
______![]() (填写>、=,<)
(填写>、=,<)
②下列各项能说明该反应已达到平衡状态的是_______(填字母)
a. 容器内![]() 、
、![]() 、
、![]() 的浓度之比为1:3:2
的浓度之比为1:3:2
b. ![]()
c. 容器内压强保持不变
d. 混合气体的密度保持不变
(3)对反应![]()
![]() H>0,在温度分别为
H>0,在温度分别为![]() 、
、![]() 时,平衡体系中
时,平衡体系中![]() 的体积分数随压强变化曲线如下图所示。
的体积分数随压强变化曲线如下图所示。

①A、C两点的反应速率:A_________C(填>、=、<)
②A、C两点![]() 的转化率:A_________C(填>、=、<)
的转化率:A_________C(填>、=、<)
③由状态B到状态A,可以采用的方法是__________。
(4)一定温度下
①若在1L的密闭容器中,充入1 mol![]() 和3 mol
和3 mol![]() 发生反应,并维持容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则
发生反应,并维持容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则![]() 的转化率a(
的转化率a(![]() )=______,以
)=______,以![]() 表示该过程的反应速率v(
表示该过程的反应速率v(![]() )=_________.
)=_________.
②若在1L的密闭容器中,充入2mol![]() 和6mol
和6mol![]() 发生反应,并维持压强恒定,达到平衡时,
发生反应,并维持压强恒定,达到平衡时, ![]() 平衡浓度比①中
平衡浓度比①中![]() 平衡浓度的2倍________。(填>、=、<)
平衡浓度的2倍________。(填>、=、<)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com